
【题目】在微电子工业中 NF3 常用作氮化硅的蚀刻剂,工业上通过电解含 NH4F 等的无水熔融物生产NF3,其电解原理如图。下列说法不正确的是( )

A. a 电极为电解池的阳极
B. 阳极的电极反应式: NH4++3F--6e—===NF3+4H+
C. H+由b极移向a极,并参与电极反应
D. 电解过程中可能还会生成少量氧化性极强的气体单质,该气体的分子式为 F2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】【2016北京卷】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
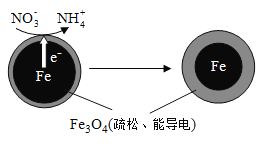
①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
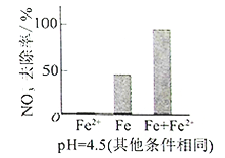
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。
(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用氧化剂,在实验室和医疗上有非常广泛的应用。以下是工业上用软锰矿(主要含MnO2)制备高锰酸钾晶体的一种工艺流程:

(1)操作Ⅱ的名称是_______,实验室进行该操作须用到的玻璃仪器有 ;
(2)反应②的产物中,氧化产物与还原产物的物质的 量之比是______;
(3)反应②中“酸化”时不能选择下列酸中的______(填字母序号)
a.稀盐酸 b.稀硫酸 c.稀醋酸
(4)电解锰酸钾溶液也可以制备高锰酸钾,其阴极反应式为:2H2O + 2e-= 2OH-+ H2↑,如图,b为电源的_______极,电解池的阳极反应式是_______;若电解过程中收集到2.24 L H2(标准状况),则得到高锰酸钾______g。(提示:阴离子放电顺序MnO42->OH-)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是
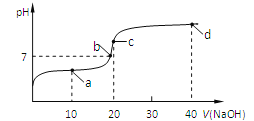
A. a点时:c(CH3COOH) >c(Na+)>c(CH3COO-)>c(H+) >c(OH-)
B. b点时:c(Na+)=c(CH3COO-)
C. c点时:c(OH-)=c(CH3COOH)+ c(H+)
D. d点时:c(Na+) > c(CH3COO-)>c(OH-) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,向2 L密闭容器中加入1 mol NO和1 mol活性炭,发生反应:2NO(g)+C(s)![]() N2(g)+CO2(g)△H=-213.5 kJ/mol,达到平衡时的数据如下:
N2(g)+CO2(g)△H=-213.5 kJ/mol,达到平衡时的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | |
T2 | 0.25 |
下列说法不正确的是
A. 上述信息可推知:T1<T2
B. T1℃时,该反应的平衡常数K=9/16
C. T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
D. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的示意图如图所示。下列说法正确的是

A.放电时,N为负极,其电极反应式:PbO2+SO42-+4H++2e-=PbSO4+2H2O
B.放电时,c(H2 SO4)不变,两极的质量增加
C.充电时,阳极反应式:PbSO4+2e-=Pb+SO42-
D.充电时,若N连电源正极,则该极生成PbO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体在有机合成、无机合成等方面有着重要应用。咪唑是合成“离子液体”的一种原料,其结构如图所示。下列有关咪唑说法不正确的是
![]()
A. 化学式C3H4N2
B. 分子中含有一种非极性键和两种极性键
C. 可以发生取代、加成、氧化反应
D. 一氯取代物的同分异构体共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。

下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.c点,两溶液中含有相同量的OH-
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 A常用于食品行业。已知 9.0 g A 在足量 O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重 5.4g 和 13.2 g,经检验剩余气体为 O2。
(1) A 分子的质谱图如图所示,从图中可知其摩尔质量是_________,则 A 的分子式是___________;

(2)A 能与 NaHCO3 溶液发生反应,且 A 分子的核磁共振氢谱有4个吸收峰,峰面积之比是 1:1:1:3,A中含有的官能团名称是___________;
(3)写出 A 生成聚合物的化学方程式___________;
(4)请按照系统命名法写出官能团与 A 相同的同分异构体的名称___________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com