
【题目】室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是
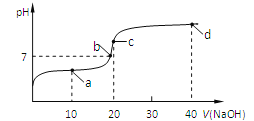
A. a点时:c(CH3COOH) >c(Na+)>c(CH3COO-)>c(H+) >c(OH-)
B. b点时:c(Na+)=c(CH3COO-)
C. c点时:c(OH-)=c(CH3COOH)+ c(H+)
D. d点时:c(Na+) > c(CH3COO-)>c(OH-) >c(H+)
【答案】A
【解析】A、a点:加入10mL的NaOH溶液,反应后溶液中的溶质为CH3COONa和CH3COOH,且两者的物质的量相等,a点对应的溶液显酸性,即CH3COOH的电离程度大于CH3COO-水解,因此离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故A说法错误;B、b点是溶液的pH=7,因此根据电荷守恒有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液显中性,c(H+)=c(OH-),即c(Na+)=c(CH3COO-),故B说法正确;C、c点,两个溶液恰好完全反应,即溶质为CH3COONa ,根据质子守恒,因此有c(OH-)=c(H+)+c(CH3COOH),故C说法正确;D、d点时,溶质为CH3COONa和NaOH,离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D说法正确。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr) = 7.7×10-13,Ksp(Ag2CrO4) =9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 ( )
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸收能量的化学反应的是( )
A. 铝片与稀盐酸的反应 B. Ba(OH)2·8H2O与NH4Cl的反应
C. 灼热的炭与CO2反应 D. 甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.在2L的密闭容器中发生下面反应:A(g)+2B(g)=3C(g),经过3min后A的物质由10mol变为7mol,则下面表示的反应速率正确的是 ( )
A. vA=1mol·L-1·min-1 B. vA=3mol·L-1·min-1
C. vA=2mol·L-1·min-1 D. vA=0.5mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯氧化镁具有优良的性能,广泛应用于各种材料。以某厂工业废液(主要成分为MgCl2,含有少量Fe2+、Fe3+、Mn2+等)为原料制备高纯氧化镁的流程如下:

若要求产品尽量不含杂质,而且生产成本较低,请根据下表提供的数据作答。
25℃时,生成氢氧化物沉淀的pH | 原料价格表 | ||||
物质 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 价格/(元·吨-1) | |
Mg(OH)2 | 10.0 | 11.0 | 漂液(含25.5% NaClO) | 450 | |
Mn(OH)2 | 8.3 | 9.8 | 双氧水(含30% H2O2) | 2400 | |
Fe(OH)2 | 7.6 | 9.6 | 烧碱(含98% NaOH) | 2100 | |
Fe(OH)3 | 2.7 | 3.7 | 纯碱(含99.5% Na2CO3) | 600 | |
(1)漂液中NaClO的电子式为_________________;双氧水中H2O2的结构式为___________。
(2)25℃时,Ksp[Mg(OH)2]=_____________。
(3)“氧化”时,所加试剂X的最佳选择为________________,该步反应的离子方程式为____________。
(4)试剂Y的俗称为__________;“调节pH=9.8”的目的为___________________。
(5)“煮沸”时,反应的化学方程式为_______________________。
(6)常温下,取一定量的试剂Z,加水稀释成1.0 L 0.2 mol·L-1的溶液;再向其中缓慢通入0.05 mol气体A充分反应后,所得溶液中各离子浓度由大到小的顺序为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在微电子工业中 NF3 常用作氮化硅的蚀刻剂,工业上通过电解含 NH4F 等的无水熔融物生产NF3,其电解原理如图。下列说法不正确的是( )

A. a 电极为电解池的阳极
B. 阳极的电极反应式: NH4++3F--6e—===NF3+4H+
C. H+由b极移向a极,并参与电极反应
D. 电解过程中可能还会生成少量氧化性极强的气体单质,该气体的分子式为 F2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g)![]() 2NO(g) △H1=+183 kJ/mol
2NO(g) △H1=+183 kJ/mol
2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3=-1164.4 kJ/mol
则N2(g)+3H2(g)![]() 2NH3(g) △H=________kJ/mol
2NH3(g) △H=________kJ/mol
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料I | 1.0 mol/L | 3.0 mol/L | 0 |
投料II | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①该温度下合成氨反应的平衡常数表达式为________。
②按投料I进行反应,测得达到化学平衡状态时H2的转化率为40%,若按投料II进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数___________(填“变大”、“变小”或“不变”)。
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

i X代表的物理量是_________,
ii 判断L1、L2的大小关系,并简述理由:_____________。
(3)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中 c(NH4+)_________c(NO3-)(填“>”、“<”或“=”)。
②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式是__________。
③理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存, 并且溶液为无色透明的离子组是 ( )
A. NH4+ 、Al3+、SO42- 、NO3- B. K+、Fe2+、NO3-、SO42-
C. K+、Cu2+、NH4+ 、Cl- D. Na+ 、K+、NO3- 、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com