
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g)![]() 2NO(g) △H1=+183 kJ/mol
2NO(g) △H1=+183 kJ/mol
2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3=-1164.4 kJ/mol
则N2(g)+3H2(g)![]() 2NH3(g) △H=________kJ/mol
2NH3(g) △H=________kJ/mol
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料I | 1.0 mol/L | 3.0 mol/L | 0 |
投料II | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①该温度下合成氨反应的平衡常数表达式为________。
②按投料I进行反应,测得达到化学平衡状态时H2的转化率为40%,若按投料II进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数___________(填“变大”、“变小”或“不变”)。
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

i X代表的物理量是_________,
ii 判断L1、L2的大小关系,并简述理由:_____________。
(3)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中 c(NH4+)_________c(NO3-)(填“>”、“<”或“=”)。
②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式是__________。
③理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是________g。
【答案】 -92.2 K= 逆向 变小 温度 L1<L2,当温度一定时,压强越大,平衡转化率越大。 < O2+2H++2e-=H2O2 17g
逆向 变小 温度 L1<L2,当温度一定时,压强越大,平衡转化率越大。 < O2+2H++2e-=H2O2 17g
【解析】(1)已知25℃时:①N2(g)+O2(g)2NO(g)△H=+183kJ/mol
②2H2(g)+O2(g)2H2O(l)△H=﹣571.6kJ/mol
③4NH3(g)+5O2(g)4NO(g)+6H2O(l)△H=﹣1164.4kJ/mol
根据盖斯定律①+②×![]() ﹣
﹣![]() ×③得,N2(g)+3H2(g)3NH3(g)△H=+183﹣571.6×
×③得,N2(g)+3H2(g)3NH3(g)△H=+183﹣571.6×![]() +
+![]() ×1164.4=﹣92.2kJ/mol,(2)①因为合成氨反应的平衡常数=生成物浓度的幂次方之积比上反应物浓度的幂次方之积,所以N2(g)+3H2(g)3NH3(g)的平衡常数表达式为K=
×1164.4=﹣92.2kJ/mol,(2)①因为合成氨反应的平衡常数=生成物浓度的幂次方之积比上反应物浓度的幂次方之积,所以N2(g)+3H2(g)3NH3(g)的平衡常数表达式为K=![]() ;②按投料Ⅱ将氨气完全转化到右边,则与投料Ⅰ完全相同,为完全等效平衡,所以按投料Ⅱ进行反应平衡时H2的浓度也为3.0mol/L×(1﹣40%)=1.8mol/L,所以按投料Ⅱ进行反应,起始时反应进行的方向为正向,③由(1)得出合成氨为放热反应,所以升高温度平衡向逆反应方向移动,所以反应的化学平衡常数变小,④i、由图可知,X越大,氢气转化率越低,升高温度平衡向逆反应方向移动,则氢气转化率减小,则X表示温度;ii、由N2(g)+3H2(g)3NH3(g)△H<0,温度高,氢气转化率小,压强大,平衡正向移动,氢气转化率大,图中等温度时L2对应的氢气转化率大,则压强L1<L2;
;②按投料Ⅱ将氨气完全转化到右边,则与投料Ⅰ完全相同,为完全等效平衡,所以按投料Ⅱ进行反应平衡时H2的浓度也为3.0mol/L×(1﹣40%)=1.8mol/L,所以按投料Ⅱ进行反应,起始时反应进行的方向为正向,③由(1)得出合成氨为放热反应,所以升高温度平衡向逆反应方向移动,所以反应的化学平衡常数变小,④i、由图可知,X越大,氢气转化率越低,升高温度平衡向逆反应方向移动,则氢气转化率减小,则X表示温度;ii、由N2(g)+3H2(g)3NH3(g)△H<0,温度高,氢气转化率小,压强大,平衡正向移动,氢气转化率大,图中等温度时L2对应的氢气转化率大,则压强L1<L2;
(4)①向废氨水加入适量硝酸调节溶液的pH约为5,根据溶液呈电中性,溶液中c(NH4+)+c(H+)=c(NO3-)+c(OH-),pH约为5呈酸性,c(H+)>c(OH-),所以c(NH4+)<c(NO3-);②利用电解法制H2O2,在该电解池中,Ir-Ru惰性电极有吸附O2作用为氧气得电子发生还原反应,O2+2H++2e-═H2O2;③4NH3+3O22N2+6H2O中,氨气中的氮元素从-3价变为氮气中的0价,4mol氨气转移12mol电子,所以转移3mol电子,最多可以处理废氨水中溶质(以NH3计)的质量是1mol×17g/mol=17g。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】下列说法:①离子化合物含离子键,也可能含极性键或非极性键;②含金属元素的化合物不一定是离子化合物;③由非金属元素组成的化合物一定是共价化合物;④熔融状态能导电的化合物是离子化合物。其中正确的有
A. ②③④ B. ①②④
C. ①②③ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是
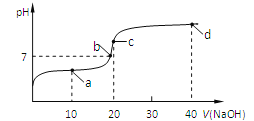
A. a点时:c(CH3COOH) >c(Na+)>c(CH3COO-)>c(H+) >c(OH-)
B. b点时:c(Na+)=c(CH3COO-)
C. c点时:c(OH-)=c(CH3COOH)+ c(H+)
D. d点时:c(Na+) > c(CH3COO-)>c(OH-) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的示意图如图所示。下列说法正确的是

A.放电时,N为负极,其电极反应式:PbO2+SO42-+4H++2e-=PbSO4+2H2O
B.放电时,c(H2 SO4)不变,两极的质量增加
C.充电时,阳极反应式:PbSO4+2e-=Pb+SO42-
D.充电时,若N连电源正极,则该极生成PbO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体在有机合成、无机合成等方面有着重要应用。咪唑是合成“离子液体”的一种原料,其结构如图所示。下列有关咪唑说法不正确的是
![]()
A. 化学式C3H4N2
B. 分子中含有一种非极性键和两种极性键
C. 可以发生取代、加成、氧化反应
D. 一氯取代物的同分异构体共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于合金性质的说法中,错误的是( )
A. 合金的硬度一般比其各成分金属的硬度高
B. 合金的熔点一般比其各成分金属的熔点低
C. 合金的物理性质一般与其各成分金属的的物理性质不同
D. 合金的化学性质一般与其各成分金属的的化学性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。

下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.c点,两溶液中含有相同量的OH-
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件一定能使反应速率加快的是:①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积 ④加入生成物 ⑤加入催化剂( )
A. 全部 B. ①②⑤ C. ② D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)有以下物质:①CH4,②C2H4,③H2O,④NH3,⑤CH2O,⑥CO2;
非极性分子的是______________;既有σ键又有π键的是______________;
中心原子没有孤电子对的是______________;中心原子杂化类型为sp3的是_______;分子构型都是直线形的是___________。(写序号)
(II) (6分)按要求完成下列问题:
写出基态铁原子的电子排布式__________;Mg2+的电子排布图__________;
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为_______;
![]() 的沸点比
的沸点比 高,原因是________________。
高,原因是________________。
(3)下列分子若是手性分子,请用“*”标出其手性碳原子。
 ________________、________________
________________、________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com