
【题目】下列条件一定能使反应速率加快的是:①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积 ④加入生成物 ⑤加入催化剂( )
A. 全部 B. ①②⑤ C. ② D. ②③
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g)![]() 2NO(g) △H1=+183 kJ/mol
2NO(g) △H1=+183 kJ/mol
2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3=-1164.4 kJ/mol
则N2(g)+3H2(g)![]() 2NH3(g) △H=________kJ/mol
2NH3(g) △H=________kJ/mol
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料I | 1.0 mol/L | 3.0 mol/L | 0 |
投料II | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①该温度下合成氨反应的平衡常数表达式为________。
②按投料I进行反应,测得达到化学平衡状态时H2的转化率为40%,若按投料II进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数___________(填“变大”、“变小”或“不变”)。
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

i X代表的物理量是_________,
ii 判断L1、L2的大小关系,并简述理由:_____________。
(3)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中 c(NH4+)_________c(NO3-)(填“>”、“<”或“=”)。
②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式是__________。
③理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种相邻短周期主族元素的相对位置如表,元素X的原子核外电子数是元素M的2倍,Y的氧化物具有两性。下列说法不正确的是
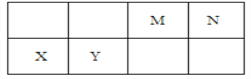
A. 基态Y原子中存在6种能量不同的电子
B. X位于第三周期IIA ,其单质可采用电解熔融其氯化物制备
C. 元素最高价氧化物的水化物中,酸性最强的是HNO3
D. 气体分子(MN)2的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液蒸干后,能析出溶质固体的是( )
①FeCl3 ②Fe2(SO4)3 ③Ca(HCO3)2 ④Na2CO3
A.仅①④ B.仅②④
C.仅①② D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质(X)是有机合成中重要中间体,下列关于它的说法正确的是( )
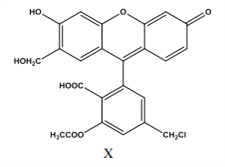
A. 1 mol X 与与足量的 NaOH 溶液反应, 最多消耗 6mol NaOH
B. 1 mol X 最多能与 10mol 氢气反应,且生成物中无手性碳原子
C. 1mol X 与足量的浓溴水反应,最多消耗 2mol Br2
D. X 分子式为 C24H17O8Cl,是芳香族化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存, 并且溶液为无色透明的离子组是 ( )
A. NH4+ 、Al3+、SO42- 、NO3- B. K+、Fe2+、NO3-、SO42-
C. K+、Cu2+、NH4+ 、Cl- D. Na+ 、K+、NO3- 、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合时体积变化)
① | ② | ③ | ④ | |
pH | 12 | 12 | 2 | 2 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. 在①②中分别加入氯化铵晶体,两溶液的pH值均增大
B. 分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C. 把①④两溶液等体积混合后所得溶液显酸性
D. 将溶液②和溶液③等体积混合,混合后所得溶液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香酸是分子中羧基与苯环直接相连的一类有机物,通常用芳香烃的氧化来制备。反应原理如下:

反应试剂、产物的物理常数:
名称 | 相对分子质量 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) | 水中的溶解性 |
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 |
主要实验装置和流程如下:

实验方法:一定量的甲苯和KMnO4溶液里于图l 装置中,在90℃时,反应一段时间后,
停止反应,按如下流程分离出苯甲酸并回收未反应的甲苯。

(1)白色固体B中主要成分的分子式为________。操作Ⅱ为________。
(2)如果滤液呈紫色,需加入亚硫酸氢钾,用离子方程式表示其原因__________。
(3)下列关于仪器的组装或者使用正确的是__________。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.如图 回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是上进下出
(4)除去残留在苯甲酸中的甲苯应先加入______,分液,然后再向水层中加入______,抽滤,洗涤,干燥即可得到苯甲酸。
(5)纯度测定:称取2.440g产品,配成100mL溶液,取其中25.00mL 溶液,进行滴定,消耗KOH物质的量为4.5×10-3mol。产品中苯甲酸质量分数为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com