
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。

下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.c点,两溶液中含有相同量的OH-
D.a、d两点对应的溶液均显中性
【答案】C
【解析】
试题分析:A.Ba(OH)2溶液和H2SO4、NaHSO4溶液反应方程式分别为H2SO4+Ba(OH)2=BaSO4↓+2H2O、NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,溶液导电能力与离子浓度成正比,根据图知,曲线①在a点溶液导电能力接近0,说明该点溶液离子浓度最小,应该为Ba(OH)2溶液和H2SO4的反应,则曲线②为Ba(OH)2溶液和NaHSO4溶液的反应,即①代表滴加H2SO4溶液的变化曲线,故A正确;B.根据图知,a点为Ba(OH)2溶液和H2SO4恰好反应,H2SO4、NaHSO4溶液的物质的量浓度相等,则b点溶液溶质为NaOH,所以b点,溶液中大量存在的离子是Na+、OH-,故B正确;C.c点,①中稀硫酸过量,溶质为硫酸,②中硫酸氢钠过量,则溶质为NaOH、Na2SO4,因为硫酸根离子浓度相同,②中钠离子浓度大于①中氢离子浓度,所以溶液中氢氧根离子浓度不同,故C错误;D.a点①中硫酸和氢氧化钡恰好完全反应,溶液中只含水;d点②中溶质为Na2SO4,水和硫酸钠溶液都呈中性,故D正确;故选C。


科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸收能量的化学反应的是( )
A. 铝片与稀盐酸的反应 B. Ba(OH)2·8H2O与NH4Cl的反应
C. 灼热的炭与CO2反应 D. 甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在微电子工业中 NF3 常用作氮化硅的蚀刻剂,工业上通过电解含 NH4F 等的无水熔融物生产NF3,其电解原理如图。下列说法不正确的是( )

A. a 电极为电解池的阳极
B. 阳极的电极反应式: NH4++3F--6e—===NF3+4H+
C. H+由b极移向a极,并参与电极反应
D. 电解过程中可能还会生成少量氧化性极强的气体单质,该气体的分子式为 F2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g)![]() 2NO(g) △H1=+183 kJ/mol
2NO(g) △H1=+183 kJ/mol
2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3=-1164.4 kJ/mol
则N2(g)+3H2(g)![]() 2NH3(g) △H=________kJ/mol
2NH3(g) △H=________kJ/mol
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料I | 1.0 mol/L | 3.0 mol/L | 0 |
投料II | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①该温度下合成氨反应的平衡常数表达式为________。
②按投料I进行反应,测得达到化学平衡状态时H2的转化率为40%,若按投料II进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数___________(填“变大”、“变小”或“不变”)。
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

i X代表的物理量是_________,
ii 判断L1、L2的大小关系,并简述理由:_____________。
(3)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中 c(NH4+)_________c(NO3-)(填“>”、“<”或“=”)。
②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式是__________。
③理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种细菌在酸性水溶液中,有氧气的情况下,可以将黄铜矿(主要成分是CuFe![]() ,含少量杂质SiO2)氧化为硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下:
,含少量杂质SiO2)氧化为硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下:
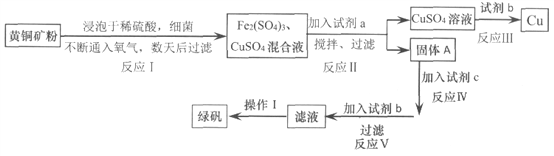
已知:
Fe2+ | Cu2+ | Fe3+ | |
开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
回答下列问题:
(1)试剂a是_________,调节溶液的pH值,为使Fe3+完全沉淀,合适pH的范围是_______。
(2)试剂b为________,请写出反应III的离子方程式________________。
(3)固体A成份是________。
(4)欲从滤液中获得绿矾晶体,操作I应为________________、洗涤干燥。
(5)反应I中参加反应的n(CuFeS2):n(O2)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种相邻短周期主族元素的相对位置如表,元素X的原子核外电子数是元素M的2倍,Y的氧化物具有两性。下列说法不正确的是
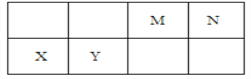
A. 基态Y原子中存在6种能量不同的电子
B. X位于第三周期IIA ,其单质可采用电解熔融其氯化物制备
C. 元素最高价氧化物的水化物中,酸性最强的是HNO3
D. 气体分子(MN)2的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液蒸干后,能析出溶质固体的是( )
①FeCl3 ②Fe2(SO4)3 ③Ca(HCO3)2 ④Na2CO3
A.仅①④ B.仅②④
C.仅①② D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存, 并且溶液为无色透明的离子组是 ( )
A. NH4+ 、Al3+、SO42- 、NO3- B. K+、Fe2+、NO3-、SO42-
C. K+、Cu2+、NH4+ 、Cl- D. Na+ 、K+、NO3- 、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三届联合国环境大会的主题为“迈向无污染的地球”。下列做法不应提倡的是
A. 推广电动汽车,践行绿色交通
B. 改变生活方式,预防废物生成
C. 回收电子垃圾,集中填埋处理
D. 弘扬生态文化,建设绿水青山
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com