
【题目】在不同温度下,向2 L密闭容器中加入1 mol NO和1 mol活性炭,发生反应:2NO(g)+C(s)![]() N2(g)+CO2(g)△H=-213.5 kJ/mol,达到平衡时的数据如下:
N2(g)+CO2(g)△H=-213.5 kJ/mol,达到平衡时的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | |
T2 | 0.25 |
下列说法不正确的是
A. 上述信息可推知:T1<T2
B. T1℃时,该反应的平衡常数K=9/16
C. T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
D. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
【答案】D
【解析】A、根据题中所给已知条件可知:
2NO(g)+C(s) ![]() N2(g)+CO2(g) ΔH=﹣213.5 kJ/mol,
N2(g)+CO2(g) ΔH=﹣213.5 kJ/mol,
开始时的浓度/ mol/L 0.5 0.5 0 0
改变(T1)的浓度/ mol/L 0.3 0.15 0.15 0.15
T1时的浓度/ mol/L 0.2 0.35 0.15 0.15
改变(T2)的浓度/ mol/L 0.25 0.125 0.125 0.125
T1时的浓度/ mol/L 0.25 0.375 0.125 0.125
K(T1)= ![]() =0.5625;K(T2)=
=0.5625;K(T2)= ![]() =0.25;
=0.25;
因 K(T1)> K(T2) 故温度T1<T2,选项A正确;B、T1℃时,该反应的平衡常数K=![]() = =
= =![]() =0.5625,选项B正确;C、T2℃时,若反应达平衡后再缩小容器的体积,相当于增大压强,该反应为等体积反应,改变压强,平衡不发生移动,故c(N2) :c (NO)不变,选项C正确;D、T1℃时,若开始时反应物的用量均减小一半,平衡逆向移动,NO的转化率减小,选项D错误。答案选D。
=0.5625,选项B正确;C、T2℃时,若反应达平衡后再缩小容器的体积,相当于增大压强,该反应为等体积反应,改变压强,平衡不发生移动,故c(N2) :c (NO)不变,选项C正确;D、T1℃时,若开始时反应物的用量均减小一半,平衡逆向移动,NO的转化率减小,选项D错误。答案选D。


科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 用银氨溶液检验乙醛的醛基: CH3CHO+2Ag(NH4)2OH![]() CH3COONH4+3NH3+2Ag↓+H2O
CH3COONH4+3NH3+2Ag↓+H2O
B. 苯酚钠溶于碳酸溶液:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
C. 硫酸铜溶液与硫化氢的反应:Cu2++H2S=CuS↓+2H+
D. 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1mol MaHSO4熔化或溶于水时电离出来的离子总数均为3NA
B. 0.1 mol NO和0.1 molO2充分反应,转移的电子数目为0.2NA
C. 常温下,1 L pH=2的CH3COOH溶液中含有的氢原子数目小于0.1NA
D. 100g质量分数为46%的乙醇溶液中含有的氢原子数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.在2L的密闭容器中发生下面反应:A(g)+2B(g)=3C(g),经过3min后A的物质由10mol变为7mol,则下面表示的反应速率正确的是 ( )
A. vA=1mol·L-1·min-1 B. vA=3mol·L-1·min-1
C. vA=2mol·L-1·min-1 D. vA=0.5mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Glaser反应在研究新型发光材料、超分子化学等方面具有重要价值。一定条件下丙炔(CH≡CCH3)发生Glaser反应制备CH3C≡C—C≡CCH3时,主要副产物为CH3CH2CH3,发生的反应为
I.2CH≡CCH3(g)![]() CH3C≡C—C=CCH3(g)+H2(g) △H1=+60 kJ·mol-1
CH3C≡C—C=CCH3(g)+H2(g) △H1=+60 kJ·mol-1
II.CH≡CCH3(g)+2H2(g)![]() CH3CH2CH3(g) △H2=-179kJ·mol-1
CH3CH2CH3(g) △H2=-179kJ·mol-1
请回答:
(1)反应II的平衡常数表达式K=__________。
(2)为提高CH3C≡C—C=CCH3的产率,可采取的措施为______(任写两条)。
(3)己知:C—H、H —H 的键能分别为414 kJ·mol-1、436 kJ·mol-1,则C—C 的键能为____ kJ·mol-1。
(4)欲提高反应I的速率,向其中加入傕化剂,使该反应分两步进行,且均为吸热反应。下如图为未加催化剂时反应I的能量变化图,请画出加入催化剂后反应过程的能量变化图_____________。
(5)一定温度下,向某恒容密闭容器中充人一定量的CH≡CCH3(g)+2H2(g),发生反应II。一段时间内测定CH3CH2CH3(g)与H2(g)的消耗速率,二者关系如下如图中AB曲线所示。B点时,该反应_________(填“是”或“否”)达到平衡状态,原因为_____________;若此时升高温度,二者速率关系相应的点可能为______________(填字母)。
(6) CH3CH2CH3碱性燃料电池是一种高性能燃料电池,其工作原理如下如图所示。b电极为________(填“正极”或“负极”),该电极的反应式为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在微电子工业中 NF3 常用作氮化硅的蚀刻剂,工业上通过电解含 NH4F 等的无水熔融物生产NF3,其电解原理如图。下列说法不正确的是( )

A. a 电极为电解池的阳极
B. 阳极的电极反应式: NH4++3F--6e—===NF3+4H+
C. H+由b极移向a极,并参与电极反应
D. 电解过程中可能还会生成少量氧化性极强的气体单质,该气体的分子式为 F2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中,可制得Cl2的正确组合是( )
①MnO2和浓盐酸混合共热 ②MnO2、NaCl和浓硫酸混合共热 ③NaClO和浓盐酸混合 ④K2Cr2O7和浓盐酸混合 ⑤KClO3和浓盐酸混合共热 ⑥KMnO4和浓盐酸混合
A. ①②⑥ B. ②④⑥
C. ①④⑥ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种细菌在酸性水溶液中,有氧气的情况下,可以将黄铜矿(主要成分是CuFe![]() ,含少量杂质SiO2)氧化为硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下:
,含少量杂质SiO2)氧化为硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下:
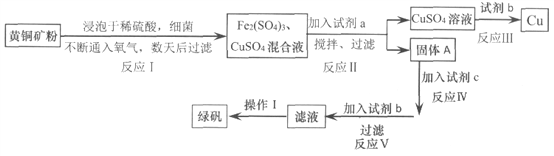
已知:
Fe2+ | Cu2+ | Fe3+ | |
开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
回答下列问题:
(1)试剂a是_________,调节溶液的pH值,为使Fe3+完全沉淀,合适pH的范围是_______。
(2)试剂b为________,请写出反应III的离子方程式________________。
(3)固体A成份是________。
(4)欲从滤液中获得绿矾晶体,操作I应为________________、洗涤干燥。
(5)反应I中参加反应的n(CuFeS2):n(O2)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿斯巴甜(F)是一种广泛应用于食品、饮料、糖果的甜味剂,其结构式为 ,合成阿斯巴甜的一种合成路线如下:
,合成阿斯巴甜的一种合成路线如下:

已知:①芳香族化合物A能发生银镜反应,核磁共振氢谱显示有5 种不同化学环境的氢。
②
③RCN ![]() RCOOH
RCOOH
④
回答下列问题:
(1)A 的名称为_________,E含有的官能团是_____________。
(2)反应①的类型是_________,反应⑤的类型是__________。
(3)C和D的结构简式分别是_______、_________。
(4)C的同分异构体中能同时满足下列条件的共有________种(不考虑立体异构)。
①苯环上有两个取代基
②能与FeCl3 溶液作用显紫色
③能与饱和NaHCO3 溶液反应产生气体
(5)参照上述合成路线,设计一条由甲醛为起始原料制备氨基乙酸的合成路线:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com