
【题目】【2016北京卷】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
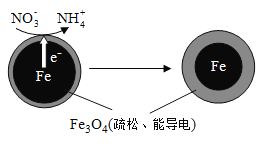
①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
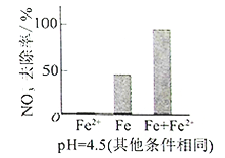
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。
(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。
【答案】(1)①铁 ②NO3-+8e-+10H+=NH4++3H2O
(2)因为铁表面生成不导电的FeO(OH),阻止反应进一步发生
(3)①本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率。
②Fe2++2FeO(OH)=Fe3O4+2H+, Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,有利于反应的进行,使NO3-的去除率提高
(4)Fe+2H+=Fe2++H2↑,初始pH较小,氢离子浓度高,产生的Fe2+浓度大,促使FeO(OH)转化为可导电的Fe3O4,使反应进行的更完全,初始pH高时,产生的Fe2+浓度小,从而造成NO3—去除率和铁的最终物质形态不同。
【解析】
试题分析:(1)①Fe是活泼的金属,根据还原水体中的NO3-的反应原理图可知,Fe被氧化作负极;
②正极发生得到电子的还原反应,因此正极是硝酸根离子被还原为NH4+,该溶液为酸性电解质溶液,结合元素和电荷守恒可知电极反应式为:NO3-+8e-+10H+=NH4++3H2O;
(2)从pH对硝酸根去除率的影响来看,初始pH=4.5时去除率低,主要是因为铁离子容易水解生成FeO(OH),同时生成的Fe3O4产率降低,且生成的FeO(OH)不导电,所以NO3-的去除率低;
(3)①从图中可以看出只加入铁粉和只加入Fe2+,NO3-的去除率都不如同时加入铁和亚铁离子的去除率高,说明不是由于亚铁离子的还原性提高了硝酸根的去除率,而是由于Fe2+破坏FeO(OH)生成了四氧化三铁;
②同位素示踪法证实Fe2+能与FeO(OH)反应生成四氧化三铁,该反应的离子方程式为:Fe2++2FeO(OH)=Fe3O4+2H+。加入Fe2+之所以可以提高硝酸根离子的转化率主要因为减少了FeO(OH)的生成,生成更多的Fe3O4,增强了导电性,另外生成了H+,可以使pH增大的速度减慢,使NO3-的转化率增大;
(4)Fe+2H+=Fe2++H2↑,初始pH较小,氢离子浓度高,产生的Fe2+浓度大,促使FeO(OH)转化为可导电的Fe3O4,使反应进行的更完全;初始pH高时,由于Fe3+的水解,Fe3+越容易生成FeO(OH),产生的Fe2+浓度小,从而造成NO3—去除率和铁的最终物质形态不同。


科目:高中化学 来源: 题型:
【题目】某些有机物的结构简式可用“键线式”表示,如(CH3)2CHCH3可用“![]() ”来表示。已知某环烷烃是平面结构,其结构如红十字协会的会徽,因此有人将它称为“红十字烷”,即“
”来表示。已知某环烷烃是平面结构,其结构如红十字协会的会徽,因此有人将它称为“红十字烷”,即“![]() ”,写出它的分子式________,当它发生一氯取代时,能生成________种沸点不同的产物。该红十字烷与乙烯(CH2===CH2)的关系为________。
”,写出它的分子式________,当它发生一氯取代时,能生成________种沸点不同的产物。该红十字烷与乙烯(CH2===CH2)的关系为________。
具有相同的分子式 B.具有相同的最简式 C.互为同系物 D.互为同分异构体
丙烯是乙烯的同系物,化学性质与乙烯相似,丙烯在一定条件下发生反应可生成高分子化合物。其方程式为_____________________________,丙烯与氢气加成后在与氯气取代生成的二氯代物的同分异构体数______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的叙述中不正确的是( )
A.可用铝制餐具长时间存放碱性食物B.可用液氨作致冷剂
C.氧化铁常用作红色油漆和涂料D.氢氧化铝可用作治疗胃酸过多的药剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr) = 7.7×10-13,Ksp(Ag2CrO4) =9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 ( )
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 用银氨溶液检验乙醛的醛基: CH3CHO+2Ag(NH4)2OH![]() CH3COONH4+3NH3+2Ag↓+H2O
CH3COONH4+3NH3+2Ag↓+H2O
B. 苯酚钠溶于碳酸溶液:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
C. 硫酸铜溶液与硫化氢的反应:Cu2++H2S=CuS↓+2H+
D. 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“富勒烯“材料家族包括C60、C70、N60、B40,下列说法正确的是
A. B40和C70都属于新型化合物 B. B40、C60、C70、N60分子内都只含共价键
C. C60和C70属于同分异构体 D. B40、C60、C70、N60都属于烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸收能量的化学反应的是( )
A. 铝片与稀盐酸的反应 B. Ba(OH)2·8H2O与NH4Cl的反应
C. 灼热的炭与CO2反应 D. 甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在微电子工业中 NF3 常用作氮化硅的蚀刻剂,工业上通过电解含 NH4F 等的无水熔融物生产NF3,其电解原理如图。下列说法不正确的是( )

A. a 电极为电解池的阳极
B. 阳极的电极反应式: NH4++3F--6e—===NF3+4H+
C. H+由b极移向a极,并参与电极反应
D. 电解过程中可能还会生成少量氧化性极强的气体单质,该气体的分子式为 F2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com