

 ×100% (7)略。
×100% (7)略。 ×106÷ag]×100%=
×106÷ag]×100%= ×100% 。
×100% 。 ×100%=
×100%= ×100%。
×100%。 

科目:高中化学 来源: 题型:

| 106(d-b) |
| 44a |
| 106(d-b) |
| 44a |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
- 3 |
- 3 |
| ||
| 106(d-b) |
| 44a |
| 106(d-b) |
| 44a |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 106(d-b) |
| 44 |
| 106(d-b) |
| 44 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 106(d-b) |
| 44a |
| 106(d-b) |
| 44a |
查看答案和解析>>
科目:高中化学 来源:2014届黑龙江大庆铁人中学高一上学期期末考试化学试卷 题型:实验题
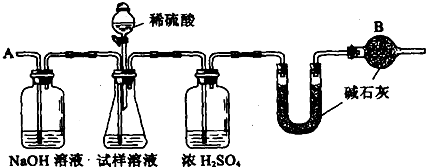
(10分).已知某纯碱试样中含有杂质氯化钠,为测定试样中纯碱的质量分数,可用下图装置进行实验。

主要步骤如下,请填空:
① 按图组装仪器,并检查装置的气密性② 将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;③ 称量盛有碱石灰的U形管的质量为b g;④ 从分液漏斗中滴入6mol/L的稀硫酸,直到不再产生气体为止,⑤ 从导管A处缓缓鼓入一定量的空气;⑥ 再次称量盛有碱石灰的U形管的质量为c g;⑦ 重复⑤和⑥的操作,直到U形管的质量基本不变,测得质量为d g。
回答下列问题:(碱石灰是一种干燥剂,不能干燥酸性气体)
(1)装置中干燥管B的作用是
(2)如果将分液漏斗中的硫酸换成同浓度的盐酸,测试的结果将 (填偏高.偏低或不变)
(3)步骤⑤的目的是
(4)步骤⑦的目的是
(5)该试样中纯碱的质量分数的计算式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com