
����Ŀ����ˮ�к��ж��ֳɷ֣�������ж������ʣ�������ˮ�ֱ�����ͼ�����������ã�������������ˮ���غϲ��ִ������ʼ�ķ�Ӧ������ˮ����������ش��������⣺

��1����Ӧd�У�����ˮ�μӵ�һ����ɫʯ����ֽ�ϣ���ֽ�ϻ������ͼ��ʾ�İ뾶�����������������Բ������������ɫ��ͬ�������й�˵������������___

A����ʵ�������ˮ�������ԡ�Ư����
B���ڻ��ʰ�ɫ��ʺ�ɫ��dz��ɫ
C���������ɫ�IJ�������˱仯�����У���ʹָʾ������ɫ�仯��������ԭ��Ӧ��
D��������ˮ��Ӧ������������HClO
��2����Ӧe�����ӷ���ʽΪ___��
��3����Ӧb��������������ɸ����巴Ӧ�Ļ�ѧ����ʽΪ___��
��4�����õ���ˮ���ջ���___�������ƣ�����Ӧa�Ļ�ѧ����ʽ��ʾΪ___��
���𰸡�C Cl2��2OH-=Cl-��ClO-��H2O Na2CO3��2HCl=2NaCl��H2O��CO2�� ���� 2HClO![]() 2HCl��O2��
2HCl��O2��
��������
��1����ˮ�������Ժ�Ư���ԣ��ݴ����������ɣ�
��2��д�������ڼ�Һ�з����绯��Ӧ�ķ���ʽ���ɣ�
��3����ˮ��̼���Ʒ�Ӧ�ı�������ˮ�е������̼���Ʒ�����Ӧ���õ�![]() ���壻
���壻
��4��������ȶ��������ֽ⣬��˾�����ˮ���յijɷ���ϡ���ᡣ
��1��A.��ˮ�ε���ֽ���룬����м�������������ɢ����˸սӴ���ˮ�IJ��ֻ��������Զ���죬�Ӵ�ʱ��õIJ�λ���������Զ���Ư�ף�A����ȷ��
B.�ڻ���Ư�ף��ʰ�ɫ����Ǻ�ɫ��dz��ɫ��B����ȷ��
C.�ڻ��Ӵ�ʱ��ã���Ӵ�ʱ�����δ��Ư�ף����֤����ɫ��Ӧ�����ʱ�������ԭ��Ӧ�����ʿ죬C�����
D.������ˮ��Ӧ�绯���õ�����������Ϊ�����ᣬD����ȷ��
��ѡC��
��2�������ڼ�Һ�з����绯��Ӧ�����Ȼ��ơ��������ƺ�ˮ����Ӧ�����ӷ���ʽΪ��![]() ��
��
��3����Ӧbʵ���Ͼ��������̼���Ʒ�Ӧ�����Ȼ��ơ�������̼��ˮ����Ӧ�Ļ�ѧ����ʽΪ��![]() ��
��
��4��������ˮʵ���Ͼ���ϡ���ᣬ��Ӧa�Ǵ��������ⷢ���ֽⷴӦ�����Ȼ������������Ӧ�Ļ�ѧ����ʽΪ��![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ի�ͭ����Ҫ�ɷ�Ϊ����ͭ��������Ԫ����ɵĻ����Ϊ����ԭ�ϣ�ͨ��һϵ�е�ұ���ɵõ�ͭ������SO2��SO3��H2SO4�����ʣ��ش��������⣺
��1����̬��ԭ�Ӽ۲�����Ų�ʽΪ____________����̬��ԭ�ӵĺ�����ӹ���_______�ֲ�ͬ����������Ԫ���������ڵķǽ���Ԫ�ص�һ�������ɴ�С��˳��Ϊ__________��
��2��SO2��SO3��H2SO4�У���ԭ�ӵ��ӻ��������Ϊsp3��������________��SO2�ķ��ӹ�����____________�����ڷǼ��Է��ӵ���������___________��
��3������Һ��Cu2+����ˮ�γɣ�Cu(H2O)6��2+������ɫ������Ӧ����Һ�м��������İ�ˮ�ɵõ���Cu(NH3)4(H2O)2��2+�����Cu(NH3)4(H2O)2��2+��Cu2+����λ����________________����ͭ��λ���뵪ͭ��λ����ȣ����ȶ�����___________________��
��4������ͭ���۵�Ϊ1326�桢�е�Ϊ1800�棻������ͭ���۵�Ϊ1235�桢�е�Ϊ1100�棬�Խ��͵������ֲ�������ܵ�ԭ����___________��
��5��������ͭ�����γɵ�ij�ֻ�����ľ�����һ�������壬�ṹ��ͼ��ʾ����û�����Ļ�ѧʽΪ____________���������ܶ�Ϊdg��cm��3�����ĸ�h=_______pm��д����ļ���ʽ���ɣ���
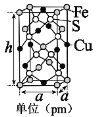
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��֧�ź�����ͷ�����ĸֹ�����������ӵ������������������з���������ԭ����ͼ��ʾ�����и߹�����Ϊ���Ը��������������йر�������ȷ����

A. ͨ�뱣������ʹ�ֹ����港ʴ�����ӽ�����
B. ͨ������·���ӱ�ǿ�ƴӸ߹���������ֹ�
C. �߹���������������Ϊ����������Ϻʹ��ݵ���
D. ͨ��ı�������Ӧ�ø��ݻ��������仯���е���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ӧ�ķ���˵����ȷ����
2Al+2NaOH+2H2O=2NaAlO2 +3H2�� 2Na2O2+2H2O=4NaOH+O2��
A.��������������Һ�ķ�Ӧ�У����ǻ�ԭ����H2O��NaOH����������
B.��������������Һ�ķ�Ӧ�У�����3mol����ת�ƣ��ͻ�����3mol��ԭ����H2
C.�ڹ���������ˮ�ķ�Ӧ�У�������Na2O2����ԭ��ΪH2O
D.�ڹ���������ˮ�ķ�Ӧ�У�ÿ��1mol����ת�ƣ�����0.5molO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܲ����أ��ṹ��ͼ���Ǿ��п���������Ч������Ȼ����֮һ����һЩʮ�ֻ���ֲ���к����Ϸḻ�������������ֶ�����Ԫ�ع��ɣ�����W��X��Y��Z��ԭ��������������Y��Zԭ�Ӻ���������������ȡ���������һ����ȷ���ǣ� ��
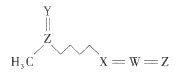
A.ԭ�Ӱ뾶�Ĵ�С˳��ΪZ>W>X>Y
B.X�ļ��⻯����W���⻯�ﷴӦ�������ӻ�����
C.�ܲ������еĸ�Ԫ��ԭ������������8�����ȶ��ṹ
D.Y��Z�γɵĶ�Ԫ�������ˮ����Ϊǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���п�Ժ������ѧ�����о�����һ�����³ɹ�ʵ���˼����Ч������ϩ�������ڴ����������⣬�������о����ɻ�ż����Ӧ������ϩ����ͼ��ʾ��

��1���ִ�ʯ�ͻ�������Ag����������ʵ����ϩ�������Ʊ�X������ʽC2H4O������˫�������÷�Ӧ�����������ԭ�Ӿ��ã���Ӧ�Ļ�ѧ����ʽ��______________���л�����д�ṹ��ʽ����
��2����֪������ʵ�ȼ�������ϱ���д�������Ʊ���ϩ���Ȼ�ѧ����ʽ_____________��
��3����400 ��ʱ�����ʼ���1 L�ĺ�ѹ��Ӧ���г���1 molCH4������������Ӧ�����ƽ����������C2H4���������Ϊ20.0%����
���ڸ��¶��£���ƽ�ⳣ��K��________��
�����������ͨ�����ˮ���������μӷ�Ӧ������400�棩��C2H4�IJ��ʽ�________��ѡ��������������С��������������ȷ��������������_____________��
������������̶�����ͬѹǿ�¿ɵñ仯����ͼ����ѹǿ�Ĺ�ϵ��__________��

��ʵ���Ʊ�C2H4ʱ��ͨ�����ڸ���Ӧ��2CH4(g) ��C2H6(g)��H2(g)����Ӧ����CH4��ʼ�����䣬��ͬ�¶���C2H6��C2H4������������¶ȵĹ�ϵ������ͼ��

A����200 ��ʱ����������������ϩ�����Ҫԭ�������_____________��
B��400��ʱ��C2H4��C2H6����������ֱ�Ϊ20.0%��6.0%������ϵ��CH4�����������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʮ�Ŵ������Ҫ����Ӯ���챣��ս������ζ�ŶԴ�����Ⱦ���αȹ�ȥҪ����ߡ���������-�������ӽ���Ĥȼ�ϵ��ʵ���������ᡢ���硢������λһ��Ľ�ϣ�ԭ����ͼ��ʾ������˵����ȷ����
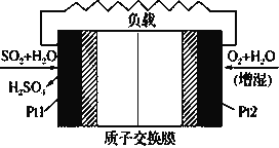
A.�õ�طŵ�ʱH+��Pt2�缫�����ڵ�·����Pt1�缫
B.Pt1�缫���������ķ�Ӧ��SO2��2H2O��2e��=H2SO4��2H��
C.Pt2�缫���������ķ�ӦΪ: O2��2H2O��4e��=4OH��
D.�ŵ�����������ĵ�22.4L O2����״������Pt1�缫������4mol H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ա���Ƴ���Ĥ��������e-��O2-ͬʱͨ������ʵ��ˮ�����ֽ��Ʊ�����������ʱCO��H2O�ֱ�����Ĥ�����෴Ӧ������ԭ����ͼ��ʾ������˵����ȷ����
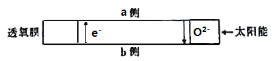
A.CO��a���Ϸ�Ӧ
B.b��ķ�Ӧʽ��H2O+2e- = H2��+ O2-
C.����Ĥ��ʵ��̫���������ܵ�ת��
D.����2mol����ͨ����Ĥʱ���ͻ�����22.4L CO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������VmL 2.0mol��L��1������������Һ����Ҫ�������ƹ�������______ g�� ���в���,��ʹ�������ҺŨ����α仯��
��1����ȡ�������ƹ���ʱ�����������ƽ���̵�ֽƬ��:______ ��
��2������ʱ���������ʹ��������:_______��
��3������ƿ������ˮϴ����û�к��:________��
��4��û�еȵ���Һ��ȴ�����¾ͽ���Һע������ƿ��:______��
��5��ת����Һʱ����Һ����:_____,
��6��û��������ˮϴ�ձ��Ͳ�����:____,
��7������ʱ����Һ��:_____,
��8������ʱ����Һ��:____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com