
【题目】对以下两个反应的分析说法正确的是
2Al+2NaOH+2H2O=2NaAlO2 +3H2↑ 2Na2O2+2H2O=4NaOH+O2↑
A.铝与氢氧化钠溶液的反应中,铝是还原剂,H2O和NaOH都是氧化剂
B.铝与氢氧化钠溶液的反应中,当有3mol电子转移,就会生成3mol还原产物H2
C.在过氧化钠与水的反应中,氧化剂Na2O2,还原剂为H2O
D.在过氧化钠与水的反应中,每有1mol电子转移,就有0.5molO2生成
科目:高中化学 来源: 题型:
【题目】某饱和链烃的含氧衍生物X具有如下性质:X+H2O![]() Y+Z,其中Y的摩尔质量为46g/mol。若X分子中有6个碳原子,则X的结构(不考虑立体结构)最多有( )
Y+Z,其中Y的摩尔质量为46g/mol。若X分子中有6个碳原子,则X的结构(不考虑立体结构)最多有( )
A.10种B.8种C.7种D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol·L-1HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。

试回答:
(1)A点沉淀的化学式为______。
(2)写出A点至B点发生反应的离子方程式_______。
(3)求原混合物中AlCl3的质量____和NaOH的物质的量____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
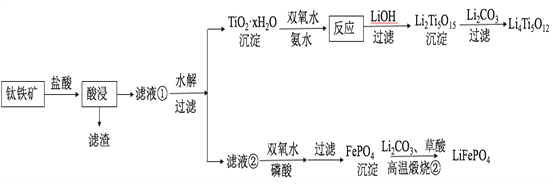
回答下列问题:
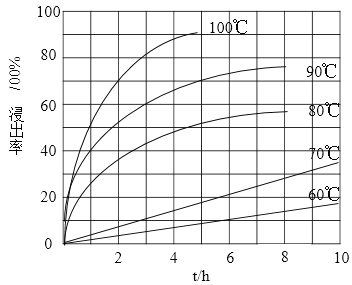
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是
A.将氯气溶于水获得新制氯水:Cl2+H2O=2H++Cl-+ClO-
B.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+
C.过量CO2通入NaAlO2溶液中制备氢氧化铝:AlO2-+CO2+2H2O=Al(OH)3↓+CO32-
D.向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁的化合物的说法不正确的是
A.实验室为了暂时妥善保存硫酸亚铁溶液,常加入少量的铁粉
B.某溶液若加入KSCN溶液,无变化,但通入Cl2后变血红色,说明原溶液中含有Fe2+
C.欲检验FeSO4溶液是否全部变质,可加入少量酸性高锰酸钾溶液观察紫色是否褪去
D.将适量铁粉放入FeCl3溶液中完全反应后,溶液中Fe2+和Fe3+的浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质作用(四种物质与氯水的重合部分代表物质间的反应,且氯水足量),请回答下列问题:

(1)反应d中,将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中错误的是___

A.此实验表明氯水具有酸性、漂白性
B.内环呈白色外环呈红色或浅红色
C.内外环上颜色的差异表明此变化过程中,酸使指示剂的颜色变化比氧化还原反应慢
D.氯气与水反应中氧化产物是HClO
(2)反应e的离子方程式为___。
(3)反应b有气体产生,生成该气体反应的化学方程式为___。
(4)久置的氯水最终会变成___(填名称),则反应a的化学方程式表示为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
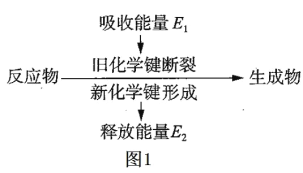
【题目】(1)如图 1 是化学反应中物质变化和能量变化的示意图。在锌与稀盐酸的反应中,E1 _____ E2 (填“>”或“<”或“=”)
(2)工业上利用 CO 和 H2 在催化剂作用下合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
则 CO(g)+2H2(g) ![]() CH3OH(g) △H=_____kJmol-1
CH3OH(g) △H=_____kJmol-1
(3)化学兴趣小组进行测定中和热的实验,装置如图,步骤如下。
a.用量筒量取 50 mL 0.50 mol·L-1 盐酸倒入如图装置的小烧杯中,测出盐酸温度。 b.用另一量筒量取 50 mL 0.55 mol·L-1 NaOH 溶液,并用另一温度计测出其温度。 c.将 NaOH 溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。
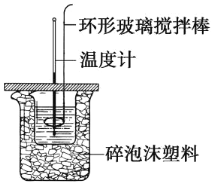
①实验中,倒入 NaOH 溶液的正确操作是_____。
A.一次性快速倒入 B.分 3 次倒入 C.边搅拌边慢慢倒入
②若将各含 1mol 溶质的 NaOH 稀溶液、Ca(OH)2 稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为 Q1、Q2、Q3,则 Q1、Q2、Q3 的关系为_____。
③假设盐酸和氢氧化钠溶液的密度都是 1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。某学生实验后,处理数据,得到实验变化的温度为 3.20℃。该实验测得中和热ΔH =_____(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用甲苯为原料生产对羟基苯甲酸乙酯![]() (—种常用的化妆品防腐剂)。其生产过程如下图所示(反应条件未全部注明),已知酚羟基(直接接连在苯环上的羟基)具有强还原性:
(—种常用的化妆品防腐剂)。其生产过程如下图所示(反应条件未全部注明),已知酚羟基(直接接连在苯环上的羟基)具有强还原性:
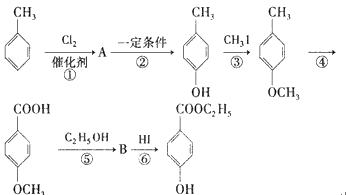
请回答下列问题:
(1)合成路线中有机物![]() 的名称为_______。
的名称为_______。
(2)有机物A的结构简式为____。
(3)写出反应②、④的反应类型:__________、__________。
(4)写出反应③的化学方程式(不必注明反应条件):__________________。
(5)在合成路线中,设计③和⑥的目的是__________。
(6)有机物![]() 的同分异构体有多种,其中既含有酚羟基又含有酯基的同分异构体共有__________种。
的同分异构体有多种,其中既含有酚羟基又含有酯基的同分异构体共有__________种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com