
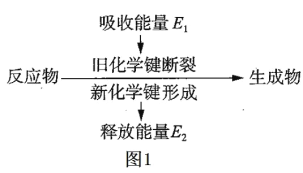
【题目】(1)如图 1 是化学反应中物质变化和能量变化的示意图。在锌与稀盐酸的反应中,E1 _____ E2 (填“>”或“<”或“=”)
(2)工业上利用 CO 和 H2 在催化剂作用下合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
则 CO(g)+2H2(g) ![]() CH3OH(g) △H=_____kJmol-1
CH3OH(g) △H=_____kJmol-1
(3)化学兴趣小组进行测定中和热的实验,装置如图,步骤如下。
a.用量筒量取 50 mL 0.50 mol·L-1 盐酸倒入如图装置的小烧杯中,测出盐酸温度。 b.用另一量筒量取 50 mL 0.55 mol·L-1 NaOH 溶液,并用另一温度计测出其温度。 c.将 NaOH 溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。
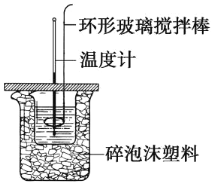
①实验中,倒入 NaOH 溶液的正确操作是_____。
A.一次性快速倒入 B.分 3 次倒入 C.边搅拌边慢慢倒入
②若将各含 1mol 溶质的 NaOH 稀溶液、Ca(OH)2 稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为 Q1、Q2、Q3,则 Q1、Q2、Q3 的关系为_____。
③假设盐酸和氢氧化钠溶液的密度都是 1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。某学生实验后,处理数据,得到实验变化的温度为 3.20℃。该实验测得中和热ΔH =_____(结果保留一位小数)。
【答案】< 99 A Q2> Q1>Q3 -53.5kJ/mol
【解析】
(1)活泼金属与酸的反应属于放热反应,即反应物的总键能小于生成物的总键能,反应物断键吸收的能量E1小于生成物成键释放的能量E2;
故答案为:<;
(2)根据反应CO(g)+2H2(g) ![]() CH3OH(g),反应热=反应物总键能生成物总键能,故△H=1076 kJ/mol +2×436 kJ/mol (3×413+343+465) kJ/mol =99 kJ/mol;
CH3OH(g),反应热=反应物总键能生成物总键能,故△H=1076 kJ/mol +2×436 kJ/mol (3×413+343+465) kJ/mol =99 kJ/mol;
答案为:99;
(3)①倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,
故答案为:A;
②中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,含 1mol 氢氧化钠的稀氢氧化钠溶液和足量稀盐酸完全反应生成1mol水,放热57.3kJ;含 1mol 氢氧化钙的稀氢氧化钙溶液和足量稀盐酸完全反应生成2mol水,放热57.3 kJ×2=114.6kJ;一水合氨是弱电解质,存在电离平衡,电离过程是吸热,含 1mol一水合氨的稀氨水和足量的稀盐酸完全反应生成1mol水,放热小于57.3kJ,所以Q2> Q1>Q3;
故答案为:Q2> Q1>Q3;
③根据中和反应:H+ +OH- =H2O,50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液反应生成0.025mol的水;50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×3.20℃=1.3776kJ,即生成0.025mol的水放出热量为:1.3776kJ,所以生成1mol的水放出热量为1.3776kJ×![]() =53.5kJ,即该实验测得的中和热△H=-53.5kJ/mol;
=53.5kJ,即该实验测得的中和热△H=-53.5kJ/mol;
故答案为:-53.5kJ/mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:

回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________________;得到滤渣1的主要成分为________________。
(2)第②步加入H2O2的作用是______________________________________,使用H2O2的优点是______________________________________________;调节pH的目的是使_______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
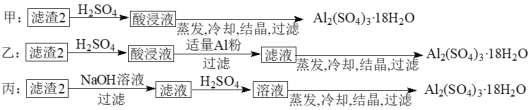
上述三种方案中,______方案不可行 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对以下两个反应的分析说法正确的是
2Al+2NaOH+2H2O=2NaAlO2 +3H2↑ 2Na2O2+2H2O=4NaOH+O2↑
A.铝与氢氧化钠溶液的反应中,铝是还原剂,H2O和NaOH都是氧化剂
B.铝与氢氧化钠溶液的反应中,当有3mol电子转移,就会生成3mol还原产物H2
C.在过氧化钠与水的反应中,氧化剂Na2O2,还原剂为H2O
D.在过氧化钠与水的反应中,每有1mol电子转移,就有0.5molO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,如图所示。

(1)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式C2H4O,不含双键),该反应符合最理想的原子经济,则反应的化学方程式是______________(有机物请写结构简式)。
(2)已知相关物质的燃烧热如上表,写出甲烷制备乙烯的热化学方程式_____________。
(3)在400 ℃时,向初始体积1 L的恒压反应器中充入1 molCH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0%。则:
①在该温度下,其平衡常数K=________。
②若向该容器通入高温水蒸气(不参加反应,高于400℃),C2H4的产率将________(选填“增大”“减小”“不变”“无法确定”),理由是_____________。
③若容器体积固定,不同压强下可得变化如下图,则压强的关系是__________。

④实际制备C2H4时,通常存在副反应:2CH4(g) →C2H6(g)+H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如图。

A.在200 ℃时,测出乙烷的量比乙烯多的主要原因可能是_____________。
B.400℃时,C2H4、C2H6的体积分数分别为20.0%、6.0%,则体系中CH4的体积分数是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫-空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是
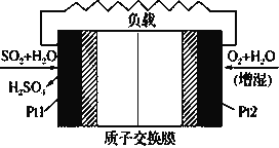
A.该电池放电时H+从Pt2电极经过内电路流到Pt1电极
B.Pt1电极附近发生的反应:SO2+2H2O-2e-=H2SO4+2H+
C.Pt2电极附近发生的反应为: O2+2H2O+4e-=4OH-
D.放电过程中若消耗的22.4L O2(标准状况),Pt1电极区增加4mol H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
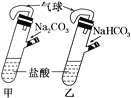
A.分别在甲乙两支侧管中装入1.06gNa2CO3和0.84gNaHCO3,试管中各有10mL相同浓度的盐酸(如图)同时将两个侧管中的物质全部倒入各自的试管中,乙装置的气球膨胀速率大
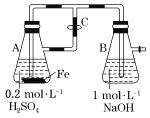
B.用如图装置可以制备沉淀Fe(OH)2
C.取少量Fe(NO3)2试样加水溶解,加稀H2SO4酸化,滴加KSCN溶液,溶液变为红色。结论:该Fe(NO3)2试样已经变质
D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液充分反应,过滤,向滤液中通入过量CO2后过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员研制出透氧膜,它允许e-和O2-同时通过,可实现水连续分解制备氢气,工作时CO、H2O分别在透氧膜的两侧反应。工作原理如图所示,下列说法正确的是
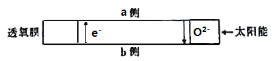
A.CO在a侧上反应
B.b侧的反应式:H2O+2e- = H2↑+ O2-
C.该透氧膜可实现太阳能向氢能的转化
D.当有2mol电子通过透氧膜时,就会消耗22.4L CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
为鉴别它们,分别完成一些实验。请根据实验的结果回答下列问题:
(1)A溶液与B溶液反应可生成气体X。根据上述六种离子之间的可能反应判断X的化学式为 ,A溶液与B溶液反应的离子方程式为 。
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为 ,B溶于水后的电离方程式为 。
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E。B溶液与C溶液反应至中性的离子方程式为 。
(4)D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为bL,则求算E在混合物中的质量分数的表达式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 2.1g丙烯中所含的共用电子对总数为0.3NA
B. 4.6gNO2和N2O4的混合气体中含有的氮原子数为0.1NA
C. 过氧化氢分解制得标准状况下2.24LO2,转移电子数目为0.4NA
D. 在高温高压、催化剂的条件下,56gN2和12gH2充分反应,生成NH3的分子数为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com