
【题目】信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:

回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________________;得到滤渣1的主要成分为________________。
(2)第②步加入H2O2的作用是______________________________________,使用H2O2的优点是______________________________________________;调节pH的目的是使_______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
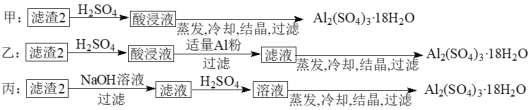
上述三种方案中,______方案不可行 。
【答案】Cu+4H++2NO3-![]() Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-![]() 3Cu2++2NO↑+4H2O Au Pt 把Fe2+氧化为Fe3+ 该氧化剂的优点是不引入杂质,产物对环境无污染 Fe3+和Al3+ 加热脱水 甲
3Cu2++2NO↑+4H2O Au Pt 把Fe2+氧化为Fe3+ 该氧化剂的优点是不引入杂质,产物对环境无污染 Fe3+和Al3+ 加热脱水 甲
【解析】
(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1的成分是Pt和Au;
(2)过氧化氢具有氧化性且被还原为水,无杂质无污染;可以氧化亚铁离子为铁离子易于沉淀除去,调节溶液PH目的是铁离子和铝离子全部沉淀;第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染.调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,滤渣2的成分为氢氧化铁和氢氧化铝;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水;
(4)依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断;
(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;第①步Cu与酸反应的离子方程式为: Cu+4H++2NO3-![]() Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-![]() 3Cu2++2NO↑+4H2O 。
3Cu2++2NO↑+4H2O 。
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+;过氧化氢做氧化剂不引入杂质,对环境无污染;调节溶液pH使Fe3+、Al3+全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜。
(3)第③步由五水硫酸铜制备硫酸铜的方法:在坩埚中加热脱水;
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙和丙方法均可行;乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;
丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO溶液 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 乙烷室温下能与浓盐酸发生取代反应 B. 乙烯可以用作生产食品包装材料的原料
C. 乙醇室温下在水中的溶解度大于溴乙烷 D. 乙酸与甲酸甲酯互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①CO2(g)+2H2(g)═ CH3OH(g)+![]() O2(g) △H=+192.9kJ/mol
O2(g) △H=+192.9kJ/mol
②H2(g)+ ![]() O2(g)═H2O(l) △H=285.8kJ/mol
O2(g)═H2O(l) △H=285.8kJ/mol
则CH3OH(g) +![]() O2(g)═CO2(g)+2H2O(l)的△H为( )
O2(g)═CO2(g)+2H2O(l)的△H为( )
A. +478.7kJ/mol
B. 764.5kJ/mol
C. 478.7kJ/mol
D. +764.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分工业上常用含少量SiO2、Al2O3的铬铁矿(FeO·Cr2O3)冶炼铬,简要流程如下:

(1)完成下列化学方程式(在横线上填写物质的化学式及计量数):
2FeO·Cr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+__________
4Na2CrO4+Fe2O3+4CO2↑+__________
(2)操作①包括过滤与洗涤,在实验室中进行洗涤沉淀的操作是_________________________,操作②可选用的装置(部分夹持装置略去)是________(填序号)。

(3)写出能够完成操作③的相关反应的化学方程式:__________________________________
(4)化学需氧量(COD)可度量水遭受有机物污染的程度。在强酸并加热的条件下,用K2Cr2O7作强氧化剂处理水样,并测定消耗的K2Cr2O7的量,然后换算成相当于O2的含量称为化学需氧量(以mg·L-1计)。化学兴趣小组测定某水样的化学需氧量(COD)过程如下:
a.取a mL水样置于锥形瓶中,加入10.00 mL 0.2500 mol·L-1的K2Cr2O7溶液。
b.……
c.加指示剂,用c mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,终点时消耗b mL(此步骤的目的是用Fe2+把多余的Cr2O72-转化为Cr3+)。
计算该水样的化学需氧量时需用到下列关系:要除去1 mol Cr2O72-需消耗__________ mol Fe2+,1 mol Cr2O72-相当于__________mol O2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量的水后,产生1.16g白色沉淀。再向所得悬浊液中逐滴加入1.00mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。试回答:

(1)写出A点到B点发生反应的离子方程式
(2)C点加入盐酸溶液的体积为 。
(3)原混合物中MgCl2的物质的量是 ,NaOH的质量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C. 向盐酸中加入氨水至中性,溶液中![]()
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向KOH溶液中通入11.2 L(标准状况)氯气恰好完全反应生成三种含氯盐: 0.7molKCl、0.2molKClO和X。则X是
A. 0.1molKClO4 B. 0.1molKClO3
C. 0.2molKClO2 D. 0.1molKClO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com