
【题目】分工业上常用含少量SiO2、Al2O3的铬铁矿(FeO·Cr2O3)冶炼铬,简要流程如下:

(1)完成下列化学方程式(在横线上填写物质的化学式及计量数):
2FeO·Cr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+__________
4Na2CrO4+Fe2O3+4CO2↑+__________
(2)操作①包括过滤与洗涤,在实验室中进行洗涤沉淀的操作是_________________________,操作②可选用的装置(部分夹持装置略去)是________(填序号)。

(3)写出能够完成操作③的相关反应的化学方程式:__________________________________
(4)化学需氧量(COD)可度量水遭受有机物污染的程度。在强酸并加热的条件下,用K2Cr2O7作强氧化剂处理水样,并测定消耗的K2Cr2O7的量,然后换算成相当于O2的含量称为化学需氧量(以mg·L-1计)。化学兴趣小组测定某水样的化学需氧量(COD)过程如下:
a.取a mL水样置于锥形瓶中,加入10.00 mL 0.2500 mol·L-1的K2Cr2O7溶液。
b.……
c.加指示剂,用c mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,终点时消耗b mL(此步骤的目的是用Fe2+把多余的Cr2O72-转化为Cr3+)。
计算该水样的化学需氧量时需用到下列关系:要除去1 mol Cr2O72-需消耗__________ mol Fe2+,1 mol Cr2O72-相当于__________mol O2。
【答案】7NaNO2 向过滤器中加入蒸馏水至浸没固体,让液体自由流下,重复2—3次DCr2O3 + 2Al![]() 2Cr +Al2O3(电解Cr2O3 也可)61.5
2Cr +Al2O3(电解Cr2O3 也可)61.5
【解析】
由制备流程结合电子得失守恒和元素守恒可知,高温下发生2FeO·Cr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,固体加水,SiO2、Al2O3、Fe2O3不溶于水,过滤得Na2CrO4溶液,Na2CrO4溶液中加入硫化钠,发生氧化还原反应得氢氧化铬沉淀和硫酸钠溶液,过滤得氢氧化铬固体,氢氧化铬固体灼烧得氧化铬,再利用铝热反或电解法冶炼可将氧化铬制得铬。
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,固体加水,SiO2、Al2O3、Fe2O3不溶于水,过滤得Na2CrO4溶液,Na2CrO4溶液中加入硫化钠,发生氧化还原反应得氢氧化铬沉淀和硫酸钠溶液,过滤得氢氧化铬固体,氢氧化铬固体灼烧得氧化铬,再利用铝热反或电解法冶炼可将氧化铬制得铬。
(1)根据反应前后元素的化合价变化可知,反应前铁元素的化合价从+2价升高到+3价,失去1个电子.Cr元素的化合价从+3价升高到+6价,失去3个电子.而O、Na、C的化合价均没有变化,所以根据电子的得失守恒可知,氮元素的化合价一定降低.由于铁元素共失去2个电子,Cr元素共失去12个电子.因此7个氮原子得到14个电子,则氮元素的化合价从+5价降低到+3价,所以还原产物是NaNO2,反应的离子方程式为2FeO·Cr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2;
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2;
(2)过滤后的沉淀洗涤是在过滤器中完成的,所以在实验室中进行洗涤沉淀的操作是向漏斗中加蒸馏水至浸没沉淀,待液体流下,重复操作2~3次;操作②是Cr(OH)3分解生成Cr2O3,固体加热分解在坩埚中进行.A是蒸发,B是分液,C是过滤,因此选D;
(3)Cr元素是高熔点金属,可以通过铝热反应或电解法冶炼,反应的方程式分别为2C2O3![]() 4Cr+3O2↑或2Al+C2O3
4Cr+3O2↑或2Al+C2O3![]() 2Cr+Al2O3 ;
2Cr+Al2O3 ;
(4)K2Cr2O7在反应中Cr元素的化合价从+6价降到+3价,得到3个电子.而亚铁离子中铁元素的化合价从+2价升到+3价,失去3个电子.根据电子得失守恒可知,去1molCr2O72-需消耗6molFe2+.由于1mol氧气做氧化剂得到4mol电子,所以molCr2O72-相当于1.5molO2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验过程中,始终无明显现象的是
A.NO2通入FeSO4溶液中B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中D.SO2通入已酸化的Ba(NO3)2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:

(1)连接好装置,装药品之前,必须进行的一项操作步骤是____________________。
(2)发生装置中盛放浓盐酸的仪器为___________,盛放二氧化锰的仪器为________________。
(3)写出烧瓶中发生反应的化学方程式:____________________________________________。
(4)B处盛有饱和食盐水,其作用是_________________________________________________。
(5)C处盛放的试剂_________,其作用是____________________________________________。
(6)E处发生反应的离子方程式为___________________________________________________。
(7)实验结束时,应先熄灭__________(填A或D)处酒精灯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丙苯[![]() ]是一种重要的化工原料,下列关于异丙苯的说法不正确的是( )
]是一种重要的化工原料,下列关于异丙苯的说法不正确的是( )
A. 异丙苯是苯的同系物
B. 可用酸性高锰酸钾溶液区别苯与异丙苯
C. 在光照的条件下,异丙苯与Cl2发生取代反应生成的氯代物有三种
D. 在一定条件下能与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同位素的应用十分广泛,如14C的放射性可用于考古断代,15N可用于生物大分子的空间结构的测定。有关叙述正确的是
A.13C与15N有相同的中子数B.14N与14C互为同位素
C.13C与14C为同一种核素D.15N的核外电子数比中子数少1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:

回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________________;得到滤渣1的主要成分为________________。
(2)第②步加入H2O2的作用是______________________________________,使用H2O2的优点是______________________________________________;调节pH的目的是使_______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
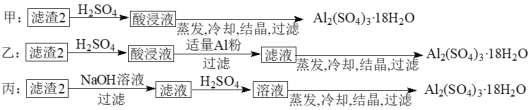
上述三种方案中,______方案不可行 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
(1)该反应的化学方程式为_______________________________;
(2)反应开始至2min,以气体Z表示的平均反应速率为________________;
(3)混合气体的平均相对分子质量比起始时___________;(填“大”,“小”或“相等”)
平衡时容器内混合气体密度比起始时______(填“大”,“小”或“相等”)
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸可与水反应生成乳酸,化学方程式如下,下列说法正确的是

A. 该反应为加成反应,没有副产物生成
B. 可用Br2/CCl4溶液鉴别丙烯酸和乳酸
C. 丙烯酸与乳酸都属于有机酸,两者不发生反应
D. 1mol乳酸分别与足量Na、NaOH、NaHCO3反应,消耗三者物质的量之比为2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C(s)+H2O(g)![]() CO(g)+H2(g)在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加C的量 B.将容器的体积缩小一半
C.容器体积可变,充入N2 D.保持容器体积不变,充入H2O(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com