
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C. 向盐酸中加入氨水至中性,溶液中![]()
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
【答案】D
【解析】
A.向0.1mol/LCH3COOH溶液中加入少量水,加水促进醋酸的电离,氢离子的物质的量增大,醋酸的物质的量减小,所以溶液中![]() 增大,选项A错误;B.升温促进醋酸根离子水解,醋酸的水解平衡常数增大,
增大,选项A错误;B.升温促进醋酸根离子水解,醋酸的水解平衡常数增大,![]() 是醋酸根离子水解平衡常数的倒数,所以题目中的比值应减小,选项B错误; C.向盐酸中加入氨水至中性,溶液中电荷守恒为c(Cl-)+c(OH-)=c(NH4+)+c(H+),显中性,即c(OH-)=c(H+),所以c(Cl-)=c(NH4+),
是醋酸根离子水解平衡常数的倒数,所以题目中的比值应减小,选项B错误; C.向盐酸中加入氨水至中性,溶液中电荷守恒为c(Cl-)+c(OH-)=c(NH4+)+c(H+),显中性,即c(OH-)=c(H+),所以c(Cl-)=c(NH4+),![]() ,选项C错误;D.AgCl、AgBr的饱和溶液中存在AgCl(s)+Br-AgBr(s)+Cl-,该反应的平衡常数K=
,选项C错误;D.AgCl、AgBr的饱和溶液中存在AgCl(s)+Br-AgBr(s)+Cl-,该反应的平衡常数K=![]() ,向溶液中加入少量AgNO3,K不变,选项D正确。答案选D。
,向溶液中加入少量AgNO3,K不变,选项D正确。答案选D。


科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:

回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________________;得到滤渣1的主要成分为________________。
(2)第②步加入H2O2的作用是______________________________________,使用H2O2的优点是______________________________________________;调节pH的目的是使_______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
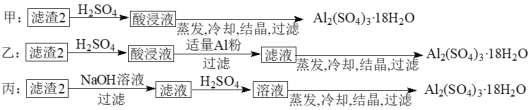
上述三种方案中,______方案不可行 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸可与水反应生成乳酸,化学方程式如下,下列说法正确的是

A. 该反应为加成反应,没有副产物生成
B. 可用Br2/CCl4溶液鉴别丙烯酸和乳酸
C. 丙烯酸与乳酸都属于有机酸,两者不发生反应
D. 1mol乳酸分别与足量Na、NaOH、NaHCO3反应,消耗三者物质的量之比为2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是

A. pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B. c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C. c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D. pH=7的溶液中:c(Na+)<2c(C2O42–)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)

A. 用装置甲检验溶液中是否有K+
B. 用装置乙制取并收集少量NH3
C. 用装置丙进行喷泉实验
D. 用装置丁加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究化学反应有重要的意义。请回答下列问题:
(1)已知在25 ℃,101 kPa下,断开1 mol H—H键要吸收436 kJ的能量,断开1 mol I—I键要吸收151 kJ的能量,断开1 mol I—H键要吸收298 kJ的能量。
①通过以上数据计算当I2和 H2反应生成2 mol H—I时会放出9kJ的能量;若将1 mol I2和1 mol H2置于密闭容器中,并在上述条件下反应,发现热量实测值(恢复到25 ℃,101 kPa)远小于上述计算值,你认为最可能的原因是_______________________。
(2)一定条件下,甲烷与水蒸气发生反应:CH4(g) + H2O(g) ![]() CO(g) + 3H2(g),工业上可利用此反应生产合成氨原料气H2。
CO(g) + 3H2(g),工业上可利用此反应生产合成氨原料气H2。
①一定温度下,向2L恒容密闭容器中充入1.6 mol CH4和2.4 mol H2O(g)发生上述反应,CO(g)的物质的量随时间的变化如图所示。0~2 min内的平均反应速率υ(H2)=__________ mol·L-1·min-1, 平衡时CH4的转化率为_____________。[转化率=![]() ×100%]
×100%]

②若要进一步提高该反应的化学反应速率,除了使用催化剂和升高温度外, 还可以采取的措施有_______________________(任写一条)。
③下列能说明上述反应达到平衡状态的是________(填代号)。
a υ逆(CH4)=3υ正(H2)
b 恒温恒容时,容器内混合气体的密度保持不变
c CH4(g)、H2O(g)的浓度保持不变
d CH4(g)、H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1:3
e 断开3 mol H-H键的同时断开2 mol O-H键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com