
【题目】工业上用甲苯为原料生产对羟基苯甲酸乙酯![]() (—种常用的化妆品防腐剂)。其生产过程如下图所示(反应条件未全部注明),已知酚羟基(直接接连在苯环上的羟基)具有强还原性:
(—种常用的化妆品防腐剂)。其生产过程如下图所示(反应条件未全部注明),已知酚羟基(直接接连在苯环上的羟基)具有强还原性:
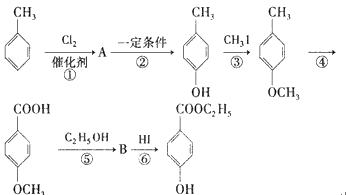
请回答下列问题:
(1)合成路线中有机物![]() 的名称为_______。
的名称为_______。
(2)有机物A的结构简式为____。
(3)写出反应②、④的反应类型:__________、__________。
(4)写出反应③的化学方程式(不必注明反应条件):__________________。
(5)在合成路线中,设计③和⑥的目的是__________。
(6)有机物![]() 的同分异构体有多种,其中既含有酚羟基又含有酯基的同分异构体共有__________种。
的同分异构体有多种,其中既含有酚羟基又含有酯基的同分异构体共有__________种。
【答案】对甲基苯酚 ![]() 取代反应 氧化反应
取代反应 氧化反应 ![]() +CH3I→
+CH3I→![]() +HI 保护酚羟基不被氧化 19
+HI 保护酚羟基不被氧化 19
【解析】
根据流程图,甲苯和氯气反应生成A,A反应生成对甲基苯酚,所以A的结构为对位取代的氯原子,故A为![]() ,由
,由![]() 与乙醇发生反应生成B,B再与HI作用生成
与乙醇发生反应生成B,B再与HI作用生成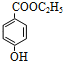 ,故B为
,故B为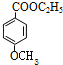 ,据此分析解答。
,据此分析解答。
(1)![]() 的名称为对甲基苯酚,故答案为:对甲基苯酚;
的名称为对甲基苯酚,故答案为:对甲基苯酚;
(2)根据流程图,由于A反应后得到的是对位取代的羟基,所以A的结构为对位取代的氯原子,故A为![]() ,故答案为:
,故答案为:![]() ;
;
(3)反应②为![]() 中氯原子被羟基取代,是取代反应,反应④为
中氯原子被羟基取代,是取代反应,反应④为![]() 中的甲基被氧化成羧基,是氧化反应,故答案为:取代反应;氧化反应;
中的甲基被氧化成羧基,是氧化反应,故答案为:取代反应;氧化反应;
(4)反应③为![]() 与碘甲烷发生取代反应,反应的方程式为
与碘甲烷发生取代反应,反应的方程式为![]() +CH3I→
+CH3I→![]() +HI,故答案为:
+HI,故答案为:![]() +CH3I→
+CH3I→![]() +HI;
+HI;
(5)在合成路线中,反应③将羟基生成醚键,反应④用强氧化剂将甲基氧化成羧基,反应⑥将醚键生成酚羟基,是因为酚羟基容易被氧化,设计③和⑥的目的是保护酚羟基不被氧化,故答案为:保护酚羟基不被氧化;
(6)根据条件,既含有酚羟基又含有酯基的![]() 的同分异构体,为苯环上连有两个基团为-OH、-COOCH3或-OH、-OOCCH3或-OH、-CH2OOCH,每种结构都有邻间对三种,也可以连三个基团为-OH、-CH3、HCOO-,有10种结构,所以共有3×3+10=19种,故答案为:19。
的同分异构体,为苯环上连有两个基团为-OH、-COOCH3或-OH、-OOCCH3或-OH、-CH2OOCH,每种结构都有邻间对三种,也可以连三个基团为-OH、-CH3、HCOO-,有10种结构,所以共有3×3+10=19种,故答案为:19。


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】对以下两个反应的分析说法正确的是
2Al+2NaOH+2H2O=2NaAlO2 +3H2↑ 2Na2O2+2H2O=4NaOH+O2↑
A.铝与氢氧化钠溶液的反应中,铝是还原剂,H2O和NaOH都是氧化剂
B.铝与氢氧化钠溶液的反应中,当有3mol电子转移,就会生成3mol还原产物H2
C.在过氧化钠与水的反应中,氧化剂Na2O2,还原剂为H2O
D.在过氧化钠与水的反应中,每有1mol电子转移,就有0.5molO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员研制出透氧膜,它允许e-和O2-同时通过,可实现水连续分解制备氢气,工作时CO、H2O分别在透氧膜的两侧反应。工作原理如图所示,下列说法正确的是
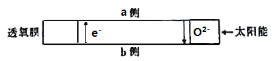
A.CO在a侧上反应
B.b侧的反应式:H2O+2e- = H2↑+ O2-
C.该透氧膜可实现太阳能向氢能的转化
D.当有2mol电子通过透氧膜时,就会消耗22.4L CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
为鉴别它们,分别完成一些实验。请根据实验的结果回答下列问题:
(1)A溶液与B溶液反应可生成气体X。根据上述六种离子之间的可能反应判断X的化学式为 ,A溶液与B溶液反应的离子方程式为 。
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为 ,B溶于水后的电离方程式为 。
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E。B溶液与C溶液反应至中性的离子方程式为 。
(4)D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为bL,则求算E在混合物中的质量分数的表达式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各性质中符合图示关系的是
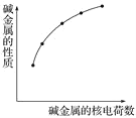
①化合价 ②ROH的碱性 ③密度 ④最外层电子数 ⑤核外电子层数 ⑥单质失e-能力
A.②④⑤⑥B.②⑤⑥C.②③⑤⑥D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,向20 mL 0.1 mol·L1 MOH溶液中滴加0.1 mol·L1 CH3COOH溶液, 所得溶液的pH(对应曲线M)及导电能力(对应曲线N)变化如图所示。下列叙述正确的是
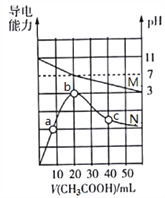
A. MOH是弱碱,其Kb=1.0×1021
B. b点溶液中,c(CH3COO)+ c(CH3COOH)=0.1 mol·L1
C. 水的离子积常数Kw:b>c>a
D. c点溶液中,c(CH3COO)>c(M+)>c(H+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制VmL 2.0mol·L-1的氢氧化钠溶液,需要氢氧化钠固体质量______ g。 下列操作,会使所配的溶液浓度如何变化。
(1)称取氢氧化钠固体时将固体放在天平托盘的纸片上:______ ;
(2)称量时左码右物,且使用了游码:_______;
(3)容量瓶用蒸馏水洗净,没有烘干:________;
(4)没有等到溶液冷却到室温就将溶液注入容量瓶中:______;
(5)转移溶液时有溶液撒出:_____,
(6)没有用蒸馏水洗烧杯和玻璃棒:____,
(7)定容时仰视液面:_____,
(8)定容时俯视液面:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 2.1g丙烯中所含的共用电子对总数为0.3NA
B. 4.6gNO2和N2O4的混合气体中含有的氮原子数为0.1NA
C. 过氧化氢分解制得标准状况下2.24LO2,转移电子数目为0.4NA
D. 在高温高压、催化剂的条件下,56gN2和12gH2充分反应,生成NH3的分子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是公认的零碳消洁能源,用乙醇为原料可通过多种方法制氢,具有理想的应用前景。回答下列问题:
(一)乙醇催化重整制氢
原理:C2H5OH(g)+3H2O(g)![]() 2CO2(g)+6H2(g)△H1
2CO2(g)+6H2(g)△H1
以Ni/凹凸棒石做催化剂,在2L刚性容器中,分别以水醇比为2:1、4:1、6:1、8:1投料(乙醇的起始物质的量相同),反应相同时间测得乙醇转化率随温度变化的关系如图所示。
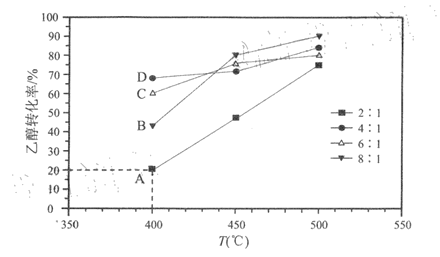
已知:过多的水分子会占据催化剂表面活性位,导致反应速率降低:上图中水醇比为2:1时,各点均已达到平衡状态。
(1)反应热△H1________0(填“>”或“<”)。若乙醇的起始物质的量为n0mol,则K(400℃)=______________(列出计算式)。
(2)400℃时,水醇比过高不利于乙醇转化的原因是____________________________;B、C、D三点中,一定未达到平衡状态的是______________(填标号)。
(二)乙醇氧化制氢
原理:C2H5OH(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+3H2(g) △H2
2CO2(g)+3H2(g) △H2
(3)已知H2(g)+![]() O2(g)
O2(g)![]() H2O(g) △H3,则△H2=_____(用含△H1和△H3的式子表示)。在密闭容器中通入一定量的乙醇和氧气,达到平衡状态后增大容器体积,则混合气体的平均相对分子质量将_________(填“增大”“减小”或“不变”)。
H2O(g) △H3,则△H2=_____(用含△H1和△H3的式子表示)。在密闭容器中通入一定量的乙醇和氧气,达到平衡状态后增大容器体积,则混合气体的平均相对分子质量将_________(填“增大”“减小”或“不变”)。
(三)乙醇电解法制氢
乙醇电解法不仅可以利用乙醇本身的氢,还可以从水中获得氢,且电解乙醇所需电压比电解水的理论电压要低很多。
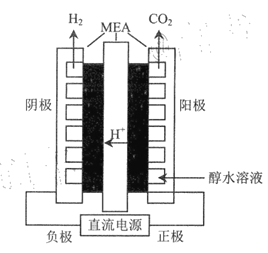
(4)利用如图所示装过(MEA为复杂的膜电极)电解乙醇制氢,阳极的电极反式应为___________,理论上每转移lmol电子,可以产生________L氢气(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com