
【题目】某饱和链烃的含氧衍生物X具有如下性质:X+H2O![]() Y+Z,其中Y的摩尔质量为46g/mol。若X分子中有6个碳原子,则X的结构(不考虑立体结构)最多有( )
Y+Z,其中Y的摩尔质量为46g/mol。若X分子中有6个碳原子,则X的结构(不考虑立体结构)最多有( )
A.10种B.8种C.7种D.6种
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是
A.C(s)+![]() O2(g)=CO(g) ΔH=-393.5kJ/mol
O2(g)=CO(g) ΔH=-393.5kJ/mol
B.2H2(g)+O2(g)=2H2O(l) ΔH =+571.6kJ/mol
C.CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
D.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH=-2800kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光气(COCl2)在农药、医药、工程塑料等方面都有广泛应用,光气常温下为无色气,有腐草味,低温时为黄绿色液体,化学性质不稳定,遇水迅速水解,生成氯化氢。某实验小组利用如下实验装置合成光气并利用光气与浓氨水反应制备尿素[CO(NH2)2]。主要实验装置(夹持装置略去)及操作步骤如下:
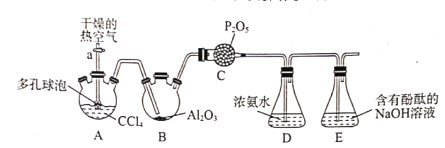
①按如图连接装置,检验装置的气密性,然后加装实验药品;
②打开活塞a.,向A中缓慢通入干燥的热空气;
③一段时间后,装置D中溶液会出现分层现象,且混合液上方有大量白色烟雾;
已知:3CC14+Al2O3=3COCl2+2AlC13
回答下列问题:
(1)检验整个装置的气密性的方法:___。
(2)步骤②中通入干燥的热空气的作用为___。
(3)装置C的作用___。
(4)装置D中反应除生成尿素[CO(NH2)2]外,还有NH4Cl生成,该反应的化学方程式为___。。
(5)分离装置D中混合液的操作名称为___。
(6)装置E中足量的NaOH溶液与少量的光气反应的离子方程式为:___。
(7)实验后,将D中溶液先蒸发结晶,再用重结晶的方法得到尿素晶体(含有少量的NH4Cl杂质),测定所得晶体中尿素的百分含量的方法:将7.07g晶体中所含氮完全转化为氨气所得氨气用100mL2.00molL-1的硫酸溶液完全吸收,取吸收液10mL用0.4000molL-1的氢氧化钠标准溶液滴定。
①到达滴定终点时,消耗氢氧化钠45.00mL,则该晶体中尿素的质量分数为___(保留3位有效数字)。
②若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得该体晶中尿素的质量分数___(选填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、W、M四种短周期主族元素,其原子序数依次增大,Y的原子半径是所有短周期主族元素中最大的,X的核外电子数与Y、M的最外层电子数之和相等,W的原子序数是M的最外层电子数的2倍,由X、Y、W三种元素形成的化合物G的结构如图所示。下列叙述不正确的是( )
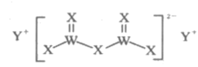
A.常见X的单质在常温下一定是气体
B.X、W的简单氢化物稳定性:X>W
C.单质Y与氧气反应的产物一定呈淡黄色
D.化合物G中X都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取50 mL某浓度的稀硫酸与一定质量的镁、铝合金反应,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液体积的关系如图所示。求原硫酸的物质的量浓度______。
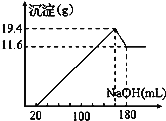
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与0.2 L 1 mol/L FeCl3溶液中的氯离子的数目相同是( )
A.0.2 L 1 mol/L KCl溶液B.0.6 mol HCl气体
C.0.2 L 3 mol/L KClO3溶液D.0.6mol NaCl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铜矿(主要成分为铁、铜、硫三种元素组成的化合物)为基本原料,通过一系列的冶炼可得到铜、铁、SO2、SO3、H2SO4等物质,回答下列问题:
(1)基态铁原子价层电子排布式为____________,基态硫原子的核外电子共有_______种不同的能量。硫元素所在周期的非金属元素第一电离能由大到小的顺序为__________。
(2)SO2、SO3、H2SO4中,硫原子的杂化轨道类型为sp3的物质是________,SO2的分子构型是____________,属于非极性分子的氧化物是___________。
(3)在溶液中Cu2+易与水形成[Cu(H2O)6]2+而显蓝色,向相应的溶液中加入足量的氨水可得到[Cu(NH3)4(H2O)2]2+,则[Cu(NH3)4(H2O)2]2+中Cu2+的配位数是________________,氧铜配位键与氮铜配位键相比,较稳定的是___________________。
(4)氧化铜的熔点为1326℃、沸点为1800℃;氧化亚铜的熔点为1235℃、沸点为1100℃,试解释导致这种差异最可能的原因是___________。
(5)由铁、铜、硫形成的某种化合物的晶胞是一个长方体,结构如图所示,则该化合物的化学式为____________。若晶体密度为dg·cm﹣3,则晶胞的高h=_______pm(写出简化后的计算式即可)。
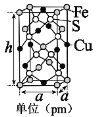
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:

回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________________;得到滤渣1的主要成分为________________。
(2)第②步加入H2O2的作用是______________________________________,使用H2O2的优点是______________________________________________;调节pH的目的是使_______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
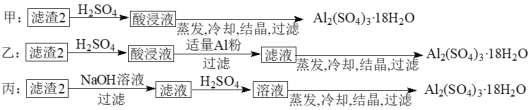
上述三种方案中,______方案不可行 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对以下两个反应的分析说法正确的是
2Al+2NaOH+2H2O=2NaAlO2 +3H2↑ 2Na2O2+2H2O=4NaOH+O2↑
A.铝与氢氧化钠溶液的反应中,铝是还原剂,H2O和NaOH都是氧化剂
B.铝与氢氧化钠溶液的反应中,当有3mol电子转移,就会生成3mol还原产物H2
C.在过氧化钠与水的反应中,氧化剂Na2O2,还原剂为H2O
D.在过氧化钠与水的反应中,每有1mol电子转移,就有0.5molO2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com