
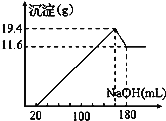
【题目】取50 mL某浓度的稀硫酸与一定质量的镁、铝合金反应,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液体积的关系如图所示。求原硫酸的物质的量浓度______。
【答案】8mol/L
【解析】
根据生成沉淀的质量与加入NaOH溶液体积的关系图可知,氢氧化钠溶液的体积为0-20ml时,氢氧化钠用于中和稀硫酸,氢氧化钠溶液的体积为20-160ml时,用于沉淀Mg2+和Al3+,氢氧化钠溶液的体积为160-180ml时,过量的氢氧化钠溶液用于溶解Al(OH)3沉淀,涉及的方程式为:Mg+H2SO4=MgSO4+H2↑,2Al+3H2SO4=Al2(SO4)3+3H2↑,MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4,Al(OH)3+NaOH=NaAlO2+2H2O,根据方程式进行计算。
根据分析可知氢氧化钠溶液加入到溶液至沉淀最大量时,硫酸全部生成硫酸钠,硫酸物质的量等于氢氧化钠物质的量的![]() ,根据图像可知,氢氧化镁物质的量等于镁的物质的量=
,根据图像可知,氢氧化镁物质的量等于镁的物质的量=![]() =0.2mol,Al(OH)3的物质的量为
=0.2mol,Al(OH)3的物质的量为![]() =0.1mol,生成沉淀共消耗氢氧化钠的物质的量为0.2mol×2+0.1mol×3=0.7mol,消耗氢氧化钠的体积为
=0.1mol,生成沉淀共消耗氢氧化钠的物质的量为0.2mol×2+0.1mol×3=0.7mol,消耗氢氧化钠的体积为![]() =0.14L,因此当加入160ml氢氧化钠溶液时,硫酸根离子全部为硫酸钠电离生成,那么硫酸的物质的量为
=0.14L,因此当加入160ml氢氧化钠溶液时,硫酸根离子全部为硫酸钠电离生成,那么硫酸的物质的量为![]() =0.4mol,浓度为
=0.4mol,浓度为![]() =8mol/L。
=8mol/L。


科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如下图(甲不一定在丁、庚的连线上),戊、己分别 是空气、地壳中含量最多的元素。下列判断正确的是
![]()
A. 甲一定是金属元素
B. 庚的最高价氧化物水化物酸性最强
C. 乙、丙、丁的最高价氧化物水化物可以以相互反应
D. 气态氢化物的稳定性:庚>己>戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如图甲所示。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示[其中a点的坐标为(9.5,0.5)]。下列溶液中的关系中正确的是( )
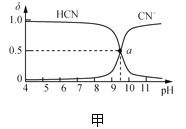
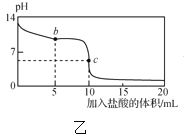
A.常温下,HCN的电离平衡常数:Ka(HCN)=10-4.5
B.图甲中pH=7的溶液:c(Cl-)=c(HCN)
C.图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是( )
A. 浓度均为0.1 mol·L-1的氨水和盐酸等体积混合后:c(H+)=c(OH-)+c(NH3·H2O)
B. 等浓度的碳酸钠、碳酸氢钠溶液混合后:c(CO![]() )<c(HCO
)<c(HCO![]() )
)
C. 在NaHB溶液中一定有:c(Na+)=c(HB-)+2c(B2-)
D. Na2CO3溶液中:2c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Fe和Fe2O3组成的混合物27.2g,与100mL一定浓度稀硫酸恰好完全反应,放出标准状况下2.24L H2,向反应后的溶液中滴入KSCN溶液,未见红色。求混合物中Fe的质量____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某饱和链烃的含氧衍生物X具有如下性质:X+H2O![]() Y+Z,其中Y的摩尔质量为46g/mol。若X分子中有6个碳原子,则X的结构(不考虑立体结构)最多有( )
Y+Z,其中Y的摩尔质量为46g/mol。若X分子中有6个碳原子,则X的结构(不考虑立体结构)最多有( )
A.10种B.8种C.7种D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物有许多重要的性质与用途,但过量排放则会导致严重的环境问题。
(1)汽车排放出的氮氧化物是导致雾霾形成的重要原因之一,汽车内安装的尾气处理器可大大降低氮氧化物的排放:2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=x kJ/mol。
已知:N2(g)+O2(g)![]() 2NO(g) ΔH=+180.50kJ/mol
2NO(g) ΔH=+180.50kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH=-566.00kJ/mol
2CO2(g) ΔH=-566.00kJ/mol
x =________________。
(2)向某恒容密闭容器中加入一定量的NO、CO并使它们之间发生反应,下图为在相同温度、压强、比表面积不同的催化剂(化学成分相同)的催化作用下,反应过程中NO的物质的量与时间之间的关系。
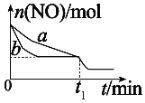
①表示催化剂比表面积较大的曲线是_________(填“a”或“b”)。
②t1min时改变(外界)的反应条件可能是____________。
(3)对于反应:mA(g)+nB(g) =pC(g)+qD(g)来说,若A、B通过一步反应能直接转化为C、D,则该反应的反应速率v=kcm(A)cn(B),其中k为只与温度有关的速率常数;若为可逆反应,则v(正)、v(逆)均存在类似的关系式,k正、k逆也只与温度有关。已知反应:2NO(g)+O2(g)![]() 2NO2(g)是通过下面两步完成的:
2NO2(g)是通过下面两步完成的:
①________________________________________(快)H1<0。
②N2O2(g)+O2(g)![]() 2NO2(g)(慢)H2<0。
2NO2(g)(慢)H2<0。
某科研小组测量出反应②的部分实验数据如下表所示:
c(N2O2)/mol/L | c(O2)/mol/L | v2正[mol/(L·s)] |
0.010 | 0.010 | 1.75 |
0.030 | 0.020 | 1.05 |
x | 0.030 | 1.05 |
i.用k2正表示②的正反应速率常数,则v2正=_________,x=_______,速率常数k2正=_______L·(mol·s)-1(填具体的数值)。
ii.在①的空白处写出化学方程式,若①②两个反应的正、逆反应速率常数分别用k1正、k1逆、k2正、k2逆表示,则2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K=____________(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化情况是________。
2NO2(g)的平衡常数K=____________(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化情况是________。
(4)在恒温恒容条件下,能表明2NO(g)+O2(g)![]() 2NO2(g)(只考虑总反应)己达到平衡状态的是_____________。
2NO2(g)(只考虑总反应)己达到平衡状态的是_____________。
a.混合气体密度保持不变 b.混合气体平均摩尔质量不变
c.正反应速率:v(NO)=v(NO2) d.生成NO2、O2的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4中含有Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程如图所示。下列说法正确的是( )
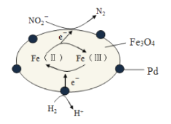
A.Pd作正极
B.Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C.反应过程中NO2-被Fe(Ⅱ)氧化为N2
D.用该法处理后水体的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是
A.将氯气溶于水获得新制氯水:Cl2+H2O=2H++Cl-+ClO-
B.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+
C.过量CO2通入NaAlO2溶液中制备氢氧化铝:AlO2-+CO2+2H2O=Al(OH)3↓+CO32-
D.向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com