
【题目】下列溶液中微粒的物质的量浓度关系正确的是( )
A. 浓度均为0.1 mol·L-1的氨水和盐酸等体积混合后:c(H+)=c(OH-)+c(NH3·H2O)
B. 等浓度的碳酸钠、碳酸氢钠溶液混合后:c(CO![]() )<c(HCO
)<c(HCO![]() )
)
C. 在NaHB溶液中一定有:c(Na+)=c(HB-)+2c(B2-)
D. Na2CO3溶液中:2c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】有机物A是一种重要的化工原料,用A制取新型聚合物F的合成路线如下:
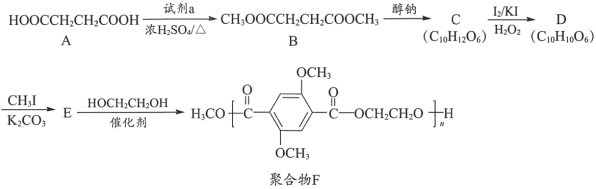
已知:i. 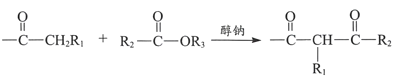 +R3OH
+R3OH
ii.  +R1I
+R1I +HI
+HI
iii.R1COOR2+R3OH![]() R1COOR3+R2OH
R1COOR3+R2OH
(1)A中官能团的名称为____________。
(2)试剂a为____________。
(3)C中含有一个六元环,C的结构简式为____________。
(4)C→D的反应类型为______。
(5)E→F的化学方程式是__________________。
(6)下列说法正确的是____________(填序号)。
a. A能与NaHCO3溶液反应
b. 醇钠可由醇与金属钠反应制得
c. 可用FeCl3溶液鉴别D和E
d. HOCH2CH2OH俗称甘油
(7)以乙醇为起始原料,利用已知信息、选择必要的无机试剂合成CH3COCH2COOC2H5写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液配制说法错误的是( )
A. 称取12.5g胆矾(CuSO4·5H2O)溶于水中,并加水稀释至500mL,所得溶液物质的量浓度为0.1mol·L-1
B. 取58.5 g NaCl固体放入1 L水中充分溶解,所得溶液中NaCl的物质的量浓度为1 mol·L-1
C. 将100g5%的食盐水加热蒸发掉50g水后,所得溶液中NaCl的质量分数为10%
D. 将浓度为2 mol·L-1硫酸钠溶液10 mL加水稀释至200 mL,所得溶液浓度为0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光气(COCl2)在农药、医药、工程塑料等方面都有广泛应用,光气常温下为无色气,有腐草味,低温时为黄绿色液体,化学性质不稳定,遇水迅速水解,生成氯化氢。某实验小组利用如下实验装置合成光气并利用光气与浓氨水反应制备尿素[CO(NH2)2]。主要实验装置(夹持装置略去)及操作步骤如下:
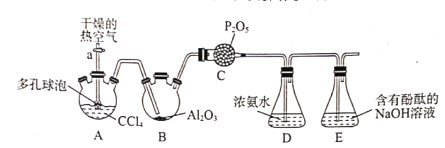
①按如图连接装置,检验装置的气密性,然后加装实验药品;
②打开活塞a.,向A中缓慢通入干燥的热空气;
③一段时间后,装置D中溶液会出现分层现象,且混合液上方有大量白色烟雾;
已知:3CC14+Al2O3=3COCl2+2AlC13
回答下列问题:
(1)检验整个装置的气密性的方法:___。
(2)步骤②中通入干燥的热空气的作用为___。
(3)装置C的作用___。
(4)装置D中反应除生成尿素[CO(NH2)2]外,还有NH4Cl生成,该反应的化学方程式为___。。
(5)分离装置D中混合液的操作名称为___。
(6)装置E中足量的NaOH溶液与少量的光气反应的离子方程式为:___。
(7)实验后,将D中溶液先蒸发结晶,再用重结晶的方法得到尿素晶体(含有少量的NH4Cl杂质),测定所得晶体中尿素的百分含量的方法:将7.07g晶体中所含氮完全转化为氨气所得氨气用100mL2.00molL-1的硫酸溶液完全吸收,取吸收液10mL用0.4000molL-1的氢氧化钠标准溶液滴定。
①到达滴定终点时,消耗氢氧化钠45.00mL,则该晶体中尿素的质量分数为___(保留3位有效数字)。
②若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得该体晶中尿素的质量分数___(选填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(52Te)被誉为“国防与尖端技术的维生素”;锡酸钠可用于制造陶瓷电容器的基体,陶瓷电容器在宇航、导弹、航海等方面有着重要的用途。以锡碲渣(主要含Na2SnO3和Na2TeO3)为原料,制备锡酸钠和碲的流程图如图:
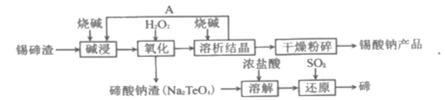
已知:锡酸钠(Na2SnO3)和亚碲酸钠(Na2TeO3)均易溶于碱。
(1)在生产过程中,要将锡碲渣粉碎,其目的是___。
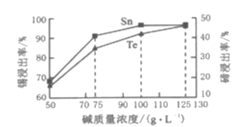
(2)“碱浸”过程中,锡碲浸出率与溶液中碱的质量浓度关系如图所示,最理想的碱的质量浓度为100g/L,其理由是___。
(3)“氧化”时,反应的离子方程式为___;“氧化”的温度控制在60℃~70℃之间,其原因是___。
(4)“还原”反应的化学方程式为___。
(5)以石墨为电极电解Na2TeO3溶液可获得Te,电解过程中阴极上的电极反应为___。
(6)常温下,向lmolL-1Na2TeO3溶液中滴加盐酸,当溶液中c(TeO32-):c(H2TeO3)=0.2时,pH=___。(已知:H2TeO3的电离平衡常数Ka1=1.0×10-3,Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、W、M四种短周期主族元素,其原子序数依次增大,Y的原子半径是所有短周期主族元素中最大的,X的核外电子数与Y、M的最外层电子数之和相等,W的原子序数是M的最外层电子数的2倍,由X、Y、W三种元素形成的化合物G的结构如图所示。下列叙述不正确的是( )
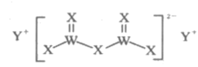
A.常见X的单质在常温下一定是气体
B.X、W的简单氢化物稳定性:X>W
C.单质Y与氧气反应的产物一定呈淡黄色
D.化合物G中X都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取50 mL某浓度的稀硫酸与一定质量的镁、铝合金反应,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液体积的关系如图所示。求原硫酸的物质的量浓度______。
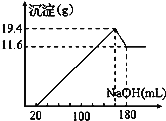
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铜矿(主要成分为铁、铜、硫三种元素组成的化合物)为基本原料,通过一系列的冶炼可得到铜、铁、SO2、SO3、H2SO4等物质,回答下列问题:
(1)基态铁原子价层电子排布式为____________,基态硫原子的核外电子共有_______种不同的能量。硫元素所在周期的非金属元素第一电离能由大到小的顺序为__________。
(2)SO2、SO3、H2SO4中,硫原子的杂化轨道类型为sp3的物质是________,SO2的分子构型是____________,属于非极性分子的氧化物是___________。
(3)在溶液中Cu2+易与水形成[Cu(H2O)6]2+而显蓝色,向相应的溶液中加入足量的氨水可得到[Cu(NH3)4(H2O)2]2+,则[Cu(NH3)4(H2O)2]2+中Cu2+的配位数是________________,氧铜配位键与氮铜配位键相比,较稳定的是___________________。
(4)氧化铜的熔点为1326℃、沸点为1800℃;氧化亚铜的熔点为1235℃、沸点为1100℃,试解释导致这种差异最可能的原因是___________。
(5)由铁、铜、硫形成的某种化合物的晶胞是一个长方体,结构如图所示,则该化合物的化学式为____________。若晶体密度为dg·cm﹣3,则晶胞的高h=_______pm(写出简化后的计算式即可)。
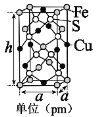
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com