
【题目】有机物A是一种重要的化工原料,用A制取新型聚合物F的合成路线如下:
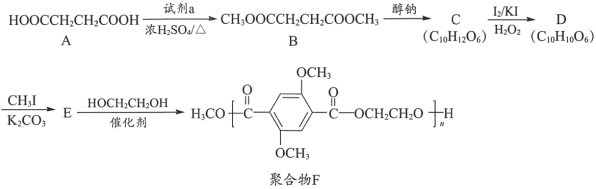
已知:i. 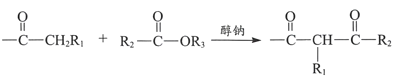 +R3OH
+R3OH
ii.  +R1I
+R1I +HI
+HI
iii.R1COOR2+R3OH![]() R1COOR3+R2OH
R1COOR3+R2OH
(1)A中官能团的名称为____________。
(2)试剂a为____________。
(3)C中含有一个六元环,C的结构简式为____________。
(4)C→D的反应类型为______。
(5)E→F的化学方程式是__________________。
(6)下列说法正确的是____________(填序号)。
a. A能与NaHCO3溶液反应
b. 醇钠可由醇与金属钠反应制得
c. 可用FeCl3溶液鉴别D和E
d. HOCH2CH2OH俗称甘油
(7)以乙醇为起始原料,利用已知信息、选择必要的无机试剂合成CH3COCH2COOC2H5写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。____________
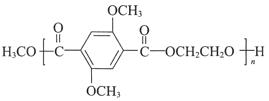
【答案】羧基 CH3OH(或甲醇) 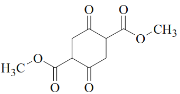 氧化反应 n
氧化反应 n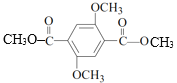 +nHOCH2CH2OH
+nHOCH2CH2OH![]()
 +(2n-1)CH3OH abc CH3CH2OH
+(2n-1)CH3OH abc CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOC2H5
CH3COOC2H5 ![]() CH3COCH2COOC2H5
CH3COCH2COOC2H5
【解析】
A是HOOCCH2CH2COOH,A与CH3OH在浓硫酸存在时加热发生酯化反应产生B:CH3OOCCH2CH2COOCH3,B与醇钠发生取代反应产生C,根据C的分子式及C中含有一个六元环,则C为: ,根据C、D分子式可知C变为D发生氧化反应,结合F的结构及E与HOCH2CH2OH发生酯交换反应产生F逆推,可知E是
,根据C、D分子式可知C变为D发生氧化反应,结合F的结构及E与HOCH2CH2OH发生酯交换反应产生F逆推,可知E是 ,D与CH3I在K2CO3作用下反应产生E,则D结构为:
,D与CH3I在K2CO3作用下反应产生E,则D结构为: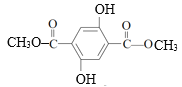 ,然后根据题目问题逐一分析解答。
,然后根据题目问题逐一分析解答。
根据上述分析可知: A是HOOCCH2CH2COOH,B:CH3OOCCH2CH2COOCH3,C是 ,D是
,D是 ,E是
,E是 ,F是
,F是 。
。
(1)A是HOOCCH2CH2COOH,可知A中官能团的名称为羧基;
(2)HOOCCH2CH2COOH与甲醇CH3OH在浓硫酸存在和加热条件下发生酯化反应产生B: CH3OOCCH2CH2COOCH3和H2O,所以试剂a是CH3OH;
(3)根据上述分析可知C结构简式为: ;
;
(4)C分子式是C10H12O6,D分子式是C10H10O6,C物质失去2个H原子变为D,失去电子被氧化,发生氧化应,故C→D的反应类型为氧化反应;
(5)E是 ,E与HOCH2CH2OH发生酯交换反应产生F,F是
,E与HOCH2CH2OH发生酯交换反应产生F,F是 ,故E→F的化学方程式是n
,故E→F的化学方程式是n +nHOCH2CH2OH
+nHOCH2CH2OH![]()
 +(2n-1)CH3OH;
+(2n-1)CH3OH;
(6)a.A是HOOCCH2CH2COOH是丁二酸,属于二元羧酸,具有酸性,由于其酸性比碳酸强,所以HOOCCH2CH2COOH能与NaHCO3溶液反应产生NaOOCCH2CH2COONa、H2O、CO2,a正确;
b. 由于金属钠能够能与醇发生置换反应产生醇钠和氢气,所以醇钠可由醇与金属钠反应制得,b正确;
c.D是 ,E是
,E是 ,D中含有酚羟基,遇FeCl3溶液显紫色,而E无酚羟基,与FeCl3溶液不能反应,因此可用FeCl3溶液鉴别D和E,c正确;
,D中含有酚羟基,遇FeCl3溶液显紫色,而E无酚羟基,与FeCl3溶液不能反应,因此可用FeCl3溶液鉴别D和E,c正确;
d.HOCH2CH2OH是乙二醇,丙三醇HOCH2CH(OH)CH2OH俗称甘油,d错误;
故合理选项是abc;
(7)乙醇催化氧化产生乙醛CH3CHO,乙醛氧化产生乙酸CH3COOH,乙酸与乙醇在浓硫酸作催化剂条件下加热,发生酯化反应产生乙酸乙酯CH3COOC2H5,CH3COOC2H5和乙醇钠反应产生CH3COCH2COOC2H5,所以以乙醇为原料合成CH3COCH2COOC2H5的路线为:CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOC2H5
CH3COOC2H5![]() CH3COCH2COOC2H5。
CH3COCH2COOC2H5。


科目:高中化学 来源: 题型:
【题目】碘是合成碘化物的基本原料。空气吹出法从卤水中提碘的流程如下:
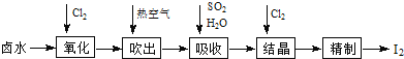
以下说法正确的是( )
A.“氧化”时,须通入过量Cl2保证I-被充分氧化
B.“吹出”操作在吹出塔中进行,应将含碘卤水从塔底进入,热空气从塔顶吹入
C.“吸收”操作中,碘蒸气与二氧化硫水溶液充分接触可生成两种酸
D.“吸收”操作中,含SO2的吸收液也可以用NaOH溶液代替,生成的I-、IO3-经酸化,即可得粗碘。使用NaOH吸收后溶液中I-、IO3-的物质的量之比为1∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示每一方框表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且加热X生成的A与C的物质的量之比为1∶1,B为常见液体。
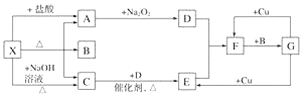
试回答下列问题:
(1)X是________(填化学式,下同),F是__________。
(2)A―→D反应的化学方程式为_______。
(3)G与Cu的反应中,G表现的性质为______。
(4)X与过量NaOH溶液反应生成C的离子方程式为_____________。
(5)以C、B、D为原料可生产G,若使amol C完全转化为G,理论上至少需要D___ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用![]() 和氨水的混合液浸取废铜矿渣中的单质铜,得到
和氨水的混合液浸取废铜矿渣中的单质铜,得到![]() 。某小组同学欲通过实验探究其原理。
。某小组同学欲通过实验探究其原理。
(查阅资料)i.![]() 呈深蓝色,
呈深蓝色,![]() ;受热易分解,放出氨气。
;受热易分解,放出氨气。
ii.![]() 在水溶液中不稳定,
在水溶液中不稳定,![]() 在溶液中只能以
在溶液中只能以![]() 等络合离子的形式稳定存在;
等络合离子的形式稳定存在;![]() 无色,易被氧气氧化为
无色,易被氧气氧化为![]() 。
。
(实验1)制备![]() 。
。
向盛有![]() 溶液的试管中滴加
溶液的试管中滴加![]() 氨水,观察到溶液中立即出现浅蓝色沉淀;随后沉淀逐渐溶解,得到深蓝色溶液。经分离得到
氨水,观察到溶液中立即出现浅蓝色沉淀;随后沉淀逐渐溶解,得到深蓝色溶液。经分离得到![]() 晶体。
晶体。
(1)资料表明,向![]() 溶液中滴加氨水,可能会生成浅蓝色
溶液中滴加氨水,可能会生成浅蓝色![]() 沉淀。
沉淀。
①该小组同学取实验1中浅蓝色沉淀,洗涤后,____________(补全实验操作和现象),证明沉淀中含有![]() 。
。
②补全实验1中生成![]() 沉淀的离子方程式:
沉淀的离子方程式:
![]() ____________+
____________+![]() ____________
____________
(2)甲同学设计实验证明深蓝色溶液中含![]() :加热深蓝色溶液并检验逸出气体为氨气。你认为此方案____________(填“可行”或“不可行”),理由是____________。
:加热深蓝色溶液并检验逸出气体为氨气。你认为此方案____________(填“可行”或“不可行”),理由是____________。
(实验2)探究用![]() 和氨水的混合液浸取单质铜得到
和氨水的混合液浸取单质铜得到![]() 的原理。
的原理。
编号 | 实验装置及部分操作 | 烧杯中溶液 | 实验现象 |
2-1 |
实验开始,先读取电压表示数,后迅速将其换成电流表,继续实验, 10 min内记录甲烧杯中现象 | 甲: 乙: | 电压表指针迅速偏转至0.1V;甲中溶液无明显变化 |
2-2 | 甲: 乙: | 电压表指针迅速偏转至0.3V;甲中溶液无明显变化 | |
2-3 | 甲: 乙:溶液A | 电压表指针迅速偏转至0.35V;甲中溶液无明显变化 | |
2-4 | 甲: 乙: | 电压表指针迅速编转至0.65V;几分钟后,甲烧杯溶液逐渐由无色变蓝色 |
已知:其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,检测到的电压越大
(3)溶液A为____________。
(4)对比实验2-1和2-2,可以得到结论是____________。
(5)实验2-4中,甲烧杯中溶液由无色变为蓝色的原因是____________。
(6)依据上述实验,分析用![]() 和氨水的混合液浸取单质铜的原理:____________。
和氨水的混合液浸取单质铜的原理:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫及其化合物的说法中正确的是
A.浓硫酸具有吸水性,可做干燥剂,如可干燥氯气、二氧化硫、氨气等
B.浓硫酸与炭共热反应,仅体现了浓硫酸的强氧化性
C.SO2 和 Cl2 均可使品红溶液褪色,但溶有 SO2 的品红溶液加热后恢复红色,说明 SO2 的氧化性没有 Cl2强
D.以 FeS2 为原料生产硫酸过程中,要用到沸腾炉、接触室、吸收塔等设备,所涉及的反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如下图(甲不一定在丁、庚的连线上),戊、己分别 是空气、地壳中含量最多的元素。下列判断正确的是
![]()
A. 甲一定是金属元素
B. 庚的最高价氧化物水化物酸性最强
C. 乙、丙、丁的最高价氧化物水化物可以以相互反应
D. 气态氢化物的稳定性:庚>己>戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从镍钼矿渣(主要含有MoO3、NiO、MgO和Fe2O3)中提取元素,其主要工业流程如图:
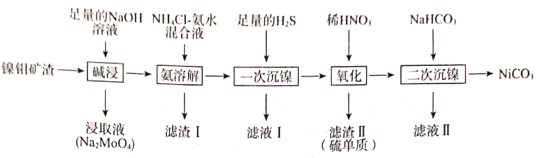
已知:①MoO3难溶于水,可溶于强碱溶液。
②Fe2O3、MgO不溶于NH4Cl—氨水混合液,NiO可溶于NH4Cl—氨水混合液生成[Ni(NH3)6]2+。
③已知部分金属离子形成氢氧化物沉淀的pH见下表:
pH(开始沉淀) | pH(完全沉淀) | |
Fe3+ | 1.52 | 3.18 |
Mg2+ | 8.10 | 9.43 |
请回答下列问题:
(1)“碱浸”时应先将镍钼矿渣粉碎,再与NaOH在80℃下反应2小时,该操作的目的为___。
(2)“碱浸”时,MoO3发生反应的离子方程式为___。
(3)“氨溶解”的目的为___,“氨溶解”过程中反应条件的选择性实验数据如图所示,“氨溶解”过程中需要控制温度在50~70℃之间,温度过高或过低都会导致产品的产量降低,请解释原因___。

(4)简述利用“滤渣I”制备纯净的铁红的方法:___。
(5)“一次沉镍”时加入H2S的目的是将镍元素转化为NiS沉淀,对应的离子方程式为___。
(6)“氧化”时发生反应的氧化剂与还原剂的物质的量之比为___。
(7)“二次沉镍”时,发生反应的离子方程式为___。
(8)已知:某温度时,Ksp(NiC2O4)=4.0×10-10,Ksp(NiCO3)=1.60×10-8。此温度下,将碳酸镍固体投入到1L一定浓度的Na2C2O4溶液中,若要一次性恰好将1molNiCO3完全转化成NiC2O4,则所需Na2C2O4溶液的浓度c(Na2C2O4)=___(忽略溶液体积的变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是( )
A. 浓度均为0.1 mol·L-1的氨水和盐酸等体积混合后:c(H+)=c(OH-)+c(NH3·H2O)
B. 等浓度的碳酸钠、碳酸氢钠溶液混合后:c(CO![]() )<c(HCO
)<c(HCO![]() )
)
C. 在NaHB溶液中一定有:c(Na+)=c(HB-)+2c(B2-)
D. Na2CO3溶液中:2c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com