
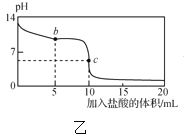
【题目】25℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如图甲所示。向10mL0.01mol·L-1NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图乙所示[其中a点的坐标为(9.5,0.5)]。下列溶液中的关系中正确的是( )
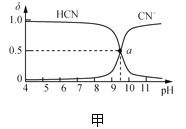
A.常温下,HCN的电离平衡常数:Ka(HCN)=10-4.5
B.图甲中pH=7的溶液:c(Cl-)=c(HCN)
C.图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
【答案】B
【解析】
A项、由图甲可知,a点c(HCN)= c(CN-),溶液中c(H+)=10-9.5,则HCN的电离平衡常数Ka(HCN)=![]() = c(H+)=10-9.5,故A错误;
= c(H+)=10-9.5,故A错误;
B项、由物料守恒可知NaCN溶液和反应后的溶液中均存在c(Na+)=c(HCN)+c(CN-),由电荷守恒关系可知溶液中存在c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CN-),pH=7的溶液中c(OH-)=c(H+),则三式合并可得c(Cl-)=c(HCN),故B正确;
C项、向10mL0.01moL/LNaCN溶液滴加入5mL0.01moL/L的盐酸,两者反应得到物质的量浓度相等的HCN、NaCN和NaCl混合液,溶液呈碱性说明NaCN的水解为大于HCN的电离,则c(HCN)> c(CN-),故C错误;
D项、图乙中c点10mL0.01moL/LNaCN溶液与10mL0.01moL/L的盐酸恰好完全反应生成氯化钠和氢氰酸混合液,由物料守恒可知,溶液中存在c(Cl-)=c(Na+)=c(HCN)+c(CN-),由电荷守恒可知,溶液中存在c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CN-),则两式合并可得c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-),故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】(1)某实验需要1mol/LNaOH溶液500mL。配制该溶液所需要的玻璃仪器有烧杯、玻璃棒、__________和 __________。
配制实验操作步骤有:
a.在天平上称量NaOH固体,加水溶解,冷却至室温。
b.把制得的溶液小心地注入一定容积容量瓶中。
c.继续向容量瓶中加水至距刻度线lcm2cm处,改用胶头滴管加水至刻度线。
d.用少量水洗涤烧杯和玻璃棒23次,每次将洗涤液转入容量瓶,并摇匀。
e.将容量瓶塞塞紧,充分摇匀。填写下列空白:
(2)操作步骤和正确顺序为_______________________。
(3)该配制过程中两次用到玻璃棒,其作用分别是_________,___________。
(4)定容时,若俯视刻度线,会使结果________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+ 6CO(g)。
Si3N4(s)+ 6CO(g)。
(1)该反应的氧化剂是___;
(2)该反应的平衡常数表达式为K=___;
(3)若知上述反应为放热反应,升高温度,其平衡常数值___(填“增大”、“减小”或“不变”);若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)=___。
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。图中t4时引起平衡移动的条件可能是___;
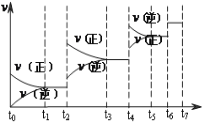
图中表示平衡混合物中CO的含量最高的一段时间是___。
(5)若该反应的平衡常数为K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2molN2充分反应,则N2的转化率是___(提示:272=729)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液配制说法错误的是( )
A. 称取12.5g胆矾(CuSO4·5H2O)溶于水中,并加水稀释至500mL,所得溶液物质的量浓度为0.1mol·L-1
B. 取58.5 g NaCl固体放入1 L水中充分溶解,所得溶液中NaCl的物质的量浓度为1 mol·L-1
C. 将100g5%的食盐水加热蒸发掉50g水后,所得溶液中NaCl的质量分数为10%
D. 将浓度为2 mol·L-1硫酸钠溶液10 mL加水稀释至200 mL,所得溶液浓度为0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6 g的铁粉加入200 mL Fe2(SO4)3和CuSO4的混合溶液中,充分反应可以得到200 mL 0.5mol /L FeSO4溶液和5.2 g固体沉淀物。试计算原混合溶液中Fe2(SO4)3的物质的量浓度_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光气(COCl2)在农药、医药、工程塑料等方面都有广泛应用,光气常温下为无色气,有腐草味,低温时为黄绿色液体,化学性质不稳定,遇水迅速水解,生成氯化氢。某实验小组利用如下实验装置合成光气并利用光气与浓氨水反应制备尿素[CO(NH2)2]。主要实验装置(夹持装置略去)及操作步骤如下:
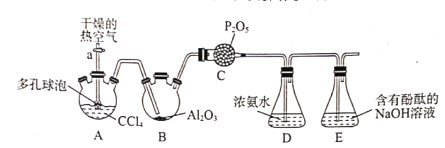
①按如图连接装置,检验装置的气密性,然后加装实验药品;
②打开活塞a.,向A中缓慢通入干燥的热空气;
③一段时间后,装置D中溶液会出现分层现象,且混合液上方有大量白色烟雾;
已知:3CC14+Al2O3=3COCl2+2AlC13
回答下列问题:
(1)检验整个装置的气密性的方法:___。
(2)步骤②中通入干燥的热空气的作用为___。
(3)装置C的作用___。
(4)装置D中反应除生成尿素[CO(NH2)2]外,还有NH4Cl生成,该反应的化学方程式为___。。
(5)分离装置D中混合液的操作名称为___。
(6)装置E中足量的NaOH溶液与少量的光气反应的离子方程式为:___。
(7)实验后,将D中溶液先蒸发结晶,再用重结晶的方法得到尿素晶体(含有少量的NH4Cl杂质),测定所得晶体中尿素的百分含量的方法:将7.07g晶体中所含氮完全转化为氨气所得氨气用100mL2.00molL-1的硫酸溶液完全吸收,取吸收液10mL用0.4000molL-1的氢氧化钠标准溶液滴定。
①到达滴定终点时,消耗氢氧化钠45.00mL,则该晶体中尿素的质量分数为___(保留3位有效数字)。
②若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得该体晶中尿素的质量分数___(选填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(52Te)被誉为“国防与尖端技术的维生素”;锡酸钠可用于制造陶瓷电容器的基体,陶瓷电容器在宇航、导弹、航海等方面有着重要的用途。以锡碲渣(主要含Na2SnO3和Na2TeO3)为原料,制备锡酸钠和碲的流程图如图:
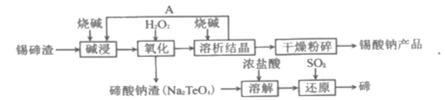
已知:锡酸钠(Na2SnO3)和亚碲酸钠(Na2TeO3)均易溶于碱。
(1)在生产过程中,要将锡碲渣粉碎,其目的是___。
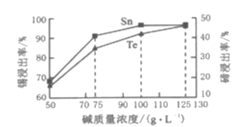
(2)“碱浸”过程中,锡碲浸出率与溶液中碱的质量浓度关系如图所示,最理想的碱的质量浓度为100g/L,其理由是___。
(3)“氧化”时,反应的离子方程式为___;“氧化”的温度控制在60℃~70℃之间,其原因是___。
(4)“还原”反应的化学方程式为___。
(5)以石墨为电极电解Na2TeO3溶液可获得Te,电解过程中阴极上的电极反应为___。
(6)常温下,向lmolL-1Na2TeO3溶液中滴加盐酸,当溶液中c(TeO32-):c(H2TeO3)=0.2时,pH=___。(已知:H2TeO3的电离平衡常数Ka1=1.0×10-3,Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
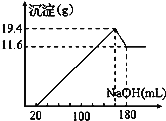
【题目】取50 mL某浓度的稀硫酸与一定质量的镁、铝合金反应,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液体积的关系如图所示。求原硫酸的物质的量浓度______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应离子的萃取,如La3+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:________,其中电子占据的轨道数为________个。
(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为________,羟基间的相互作用力为________。
(3)不同大小的苯芳烃能识别某些离子,如:![]() 、SCN-等。一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式______________________________。
、SCN-等。一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式______________________________。
(4)NH3分子在独立存在时H-N-H键角为106.7°。如图 [Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因:______。
(5)橙红色的八羰基二钴[Co2(CO)8]的熔点为52℃,可溶于乙醇、乙醚、苯等有机溶剂。该晶体属于________晶体,八羰基二钴在液氨中被金属钠还原成四羰基钴酸钠[NaCo(CO)4],四羧基钴酸钠中含有的化学键为_________________。
(6)已知C60分子结构和C60晶胞示意图(如图Ⅱ、图Ⅲ所示):

则一个C60分子中含有σ键的个数为________,C60晶体密度的计算式为________ g·cm-3。(NA为阿伏伽德罗常数的值)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com