
����Ŀ��(2016�����ջ�ѧ��13��4��)��������ʵ��������������õ��Ľ�����ȷ����(˫ѡ)( )
ѡ�� | ʵ����������� | ���� |
A | �����£�������Һ��ͨ������CO2����Һ����ǡ� | ̼������Աȱ��ӵ�ǿ |
B | �����£���Ũ�Ⱦ�Ϊ0.1 mol��L��1��BaCl2��CaCl2�����Һ�еμ�Na2SO4��Һ�����ְ�ɫ������ | Ksp(BaSO4)<Ksp(CaSO4) |
C | �����£���FeCl3��Һ�еμ�����KI��Һ���ٵμӼ��ε�����Һ����Һ����ɫ�� | Fe3���������Ա�I2��ǿ |
D | �����£���pH��ֽ��ã�0.1 mol��L��1Na2SO3��Һ��pHԼΪ10��0.1mol��L��1NaHSO3��Һ��pHԼΪ5�� | HSO |
���𰸡�AC
��������A�������£�������Һ��ͨ������CO2��������Ӧ��![]() + CO2 + H2O
+ CO2 + H2O ![]()
![]() + NaHCO3��˵��̼������Աȱ��ӵ�ǿ��A��ȷ��B�������Ϊ������ᱵΪ����������γɰ�ɫ�����������ʵ�����ж϶��ߵ�Ksp��С��B����C�������£���FeCl3��Һ�еμ�����KI��Һ��������Ӧ��2Fe3++2I�C===2Fe2++I2��Fe3���������Ա�I2��ǿ��C��ȷ��D��������������Һ�����ԣ���˵��������������ӵĵ���̶ȴ�����ˮ��̶ȣ�������ʵ��˵��HSO3�C���H����������SO32�C������D����ѡAC��
+ NaHCO3��˵��̼������Աȱ��ӵ�ǿ��A��ȷ��B�������Ϊ������ᱵΪ����������γɰ�ɫ�����������ʵ�����ж϶��ߵ�Ksp��С��B����C�������£���FeCl3��Һ�еμ�����KI��Һ��������Ӧ��2Fe3++2I�C===2Fe2++I2��Fe3���������Ա�I2��ǿ��C��ȷ��D��������������Һ�����ԣ���˵��������������ӵĵ���̶ȴ�����ˮ��̶ȣ�������ʵ��˵��HSO3�C���H����������SO32�C������D����ѡAC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ��2011��11��3��1ʱ43�֣��й��������Ƶġ����۰˺š��ɴ��롰�칬һ�š�Ŀ��������ھ����343����Ĺ���ɹ��Խӣ�Ϊ����ռ�վ�����ؼ�һ������Ϥ�����õĶ���ȼ��ΪN2O4��ƫ������[(CH3)2NNH2]��������������ȷ����
A��ƫ�����µĽṹ��ʽ��������Ϊ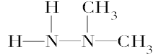
B��ƫ��������NԪ�ؾ�Ϊ��2��
C�� Ϊƫ������Ψһ��һ��ͬ���칹��
Ϊƫ������Ψһ��һ��ͬ���칹��
D��ƫ��������������������Ӧ�Ļ�ѧ����ʽΪ��(CH3)2NNH2��2N2O4��2CO2��4H2O��3N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ݻ���ͬ�������У�һ��ʢ��C3H8���壬������ʢ��N2O��CO2�Ļ�����塣��ͬ��ͬѹ�£��������ڵ�����һ��������ͬ�Ģٷ��������ܶȢ���������������ԭ����
A. �٢ڢ� B. �٢ڢ� C. �ۢܢ� D. �٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��ͬһ���ڵ�����Ԫ�أ�A��B��C��ԭ�������������1��AԪ�صĵ��ʻ�ѧ��������ã�����ˮֱ�ӷ�����Ӧ��BԪ�ص�������2.0gǡ�ø�100mL0.5mol/L��H2SO4��ȫ��Ӧ��BԪ�صĵ��ʸ�DԪ�ص��ʷ�Ӧ����BD2�ͻ��������������ʵ�ش�
��1��Aԭ�ӵĽṹʾ��ͼΪ
��2��C�����ڱ��е�λ�ã�
��3��BD2���еĻ�ѧ������Ϊ
��4��A��C��Ԫ������������ˮ�������Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ԫ��һ��ԭ�ӵ�����Ϊa g, 12C��һ��ԭ��������bg��NA�ǰ���٤��������ֵ������˵������ȷ���ǣ� ��
A. ����Ϣ��֪NA=![]()
B. ��ԭ�ӵ�Ħ��������aNA g/mol
C. w g��ԭ�ӵ����ʵ���һ����![]() mol
mol
D. w g��ԭ���к���![]() ����ԭ��
����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ���ԭ���ķ����Ǵ��ܺ��ܼ����ľ�������ǻ�ѧ�������һ���ش��ס�
(1)��������������Ӧ��A.NaOH��HCl===NaCl��H2O��B.Zn��H2SO4===ZnSO4��H2����
�ж��ܷ���Ƴ�ԭ���A__________��B__________(��ܡ����ܡ�)��
(2)����пƬ�ʹ�ͭƬ��ͼ��ʽ����100 mL��ͬŨ�ȵ�ϡ������һ��ʱ�䣬�ش��������⣺
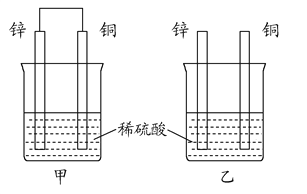
������˵����ȷ����__________��
A���ס��Ҿ�Ϊ��ѧ��ת��Ϊ���ܵ�װ��
B������ͭƬ��û�����Ա仯
C������ͭƬ�������١�����пƬ��������
D�����ձ�����Һ��pH������
������ͬʱ���ڣ����ձ��в������ݵ��ٶȣ���__________��(�>������<������)��
����д��ͼ�й���ԭ��صĸ����缫��Ӧʽ�� ____________��
�ܵ����в���1.12 L(��״��)����ʱ����п��ͭƬȡ�����ٽ��ձ��е���Һϡ����1 L�������Һ��c(H��)��0.1 mol��L��1(�跴Ӧǰ����Һ�������)����ȷ��ԭϡ��������ʵ���Ũ��Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������ѧ֪ʶ������������⣺
��1��ú����ͨ��ͨ���о���ͬ�¶��µ�ƽ�ⳣ���Խ������ʵ�����⡣��֪�������һ����̼��ˮ�������뷴Ӧ��ʱ���ᷢ�����·�Ӧ��
CO(g)+H2O(g)![]() H2(g)+CO2(g)���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯���±���ʾ��
H2(g)+CO2(g)���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯���±���ʾ��
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
������500��ʱ���з�Ӧ����CO��H2O����ʼŨ�Ⱦ�Ϊ0.020mol/L���ڸ������£�CO��ƽ��ת����Ϊ ��
��800��ʱ,�ڹ̶��ݻ����ܱ������з�������,��ʼŨ��Ϊ��c(CO)=0.01mol/L��c(H2O)=0.03mol/L��c(CO2)=0.01mol/L�� c(H2)=0.05mol/L ,����Ӧ��ʼʱ��H2���������ʱ��������� (�����С������ȷ����)��
��2��2SO2(g)+O2(g)![]() 2SO3(g)��Ӧ�����е������仯��ͼ��ʾ������֪1molSO2(g)����Ϊ1molSO3(g)�Ħ�H=-99 kJ��mol-1����ش����⣺
2SO3(g)��Ӧ�����е������仯��ͼ��ʾ������֪1molSO2(g)����Ϊ1molSO3(g)�Ħ�H=-99 kJ��mol-1����ش����⣺
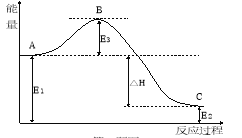
�÷�Ӧͨ����V2O5����������V2O5��ʹͼ��B�� (����ߡ����͡� )��H (��������С�����䡱)��
��3����֪ij��Ӧ��ƽ�ⳣ������ʽΪ��![]() ��������Ӧ��Ӧ�Ļ�ѧ����ʽΪ
��������Ӧ��Ӧ�Ļ�ѧ����ʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Cl2ͨ��Һ��ˮ�з���3Cl2+8NH3��H2O =6NH4Cl+N2+8H2O.����˵����ȷ����
A. Ũ��ˮ���������
B. Cl2�������Ա�N2��ǿ
C. ��1L 0.1mol/L��ˮ���������������ԣ�����NH4+��Ϊ0.1��6.02��1023
D. ���³�ѹ�£�������Ӧÿ����2.24LN2��ת�Ƶ�����Ϊ0.6��6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ������С��������ͼ��ʾװ�÷ֱ�������ʵ�飺

��1�����Թ���ע��ij��ɫ��Һ�������Թܣ���Һ��ɫ��dz����ȴ��ָ���ɫ����ԭ��Һ������_________��Һ������ʱ��Һ�ɺ�ɫ��dz��ԭ���ǣ�________________________________________��
��2�����Թ���ע��ij��ɫ��Һ�������Թܣ���Һ��Ϊ��ɫ����ȴ��ָ���ɫ�������Һ������________________��Һ������ʱ��Һ����ɫ��Ϊ��ɫ��ԭ���ǣ� ______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com