
【题目】室温下,某溶液中由水电离产生的c(H+)等于10-13mol·L-1,该溶液的溶质不可能是( )
A. NaHSO4 B. NaCl C. HCl D. Ba(OH)2
科目:高中化学 来源: 题型:
【题目】如图所示,若电解5 min时,测得铜电极的质量增加2.16 g。试回答:

(1)电源中X极是________(填“正”或“负”)极。
(2)通电5 min时,B中共收集到224 mL(标准状况)气体,溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前c(CuSO4)=________。
(3)若A中KCl溶液的体积也是200 mL,电解后溶液中仍有Cl-,则电解后溶液的c(OH-)=________。
(4)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气合成为甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)===2H2O(l) ΔH=-570 kJ·mol-1 ①
2CH3OH(l)+ 3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1 ②
写出二氧化碳与氢气合成甲醇液体的热化学方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置图或曲线图与对应的叙述相符的是
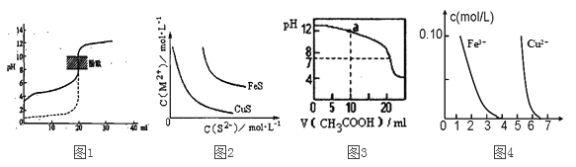
A. 如图1所示,用0.1mol/LNaOH溶液分别滴定相同物质的量浓度、相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线
B. 某温度下FeS、CuS的沉淀溶解平衡曲线如图2所示,纵坐标c(M2+)代表Fe2+或Cu2+的浓度,横坐标c(S2—)代表S2—浓度。在物质的量浓度相等的Fe2+和Cu2+的溶液中滴加硫化钠溶液,首先沉淀的离子为Fe2+
C. 如图3所示,用0.1mol/LCH3COOH溶液滴定20mL0.1mol/LNaOH溶液的滴定曲线,当pH=7时:c(Na+)=c(CH3COO—)>c(OH—)=c(H+)
D. 据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在5.5左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图实验装置制取干燥的气体正确的是

A | B | C | D |
大理石与盐酸 | 锌粒与稀硫酸 | 双氧水与二氧化锰 | 二氧化锰与氯酸钾 |
浓硫酸 | 浓硫酸 | 无水氯化钙 | 浓硫酸 |
CO2 | H2 | O2 | O2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO46H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如下图:

已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
Ksp | 8.0×10—16 | 4.0×10—38 | 6.0×10—31 | 6.5×10—18 |
完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有 。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是 (用离子方程式表示);
加入NaOH调节pH的范围是 ,为了除去溶液中的 离子。
(3)滤液Ⅱ的主要成分是 。
(4)检验Ni2+已完全沉淀的实验方法是 。
(5)操作Ⅰ的实验步骤依次为:
① ;
② ;
③蒸发浓缩、冷却结晶,过滤得NiSO46H2O晶体;
④用少量乙醇洗涤NiSO46H2O晶体并晾干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验需要0.2 mol·L-1 NaCl溶液240 mL,配制流程如下:


回答下列问题:
(1)①中称得________gNaCl。
(2)玻璃棒在②③两步中的作用分别是____________、______________。
(3)某同学在第⑧步观察液面时俯视,所配溶液浓度______(填“偏高”“偏低”或“无影响”)。
(4)容量瓶在使用之前要__________,具体操作是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背发展低碳经济的是
A.发展氢能和太阳能
B.限制塑料制品的使用
C.提高原子利用率,发展绿色化学
D.尽量用纯液态有机物代替水作溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等电子原理:原子数相同、最外层电子总数相同的分子互称为等电子体。等电子体的结构、物理性质均相似。
(1)根据以上原理,仅由第二周期元素组成的共价化合物分子中,互为等电子体的是__________和__________;________和________。
(2)此后,等电子原理又有发展。例如:由短周期元素组成的粒子,只要其原子总数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO![]() 互为等电子体的分子有:_________(写出一种即可)。
互为等电子体的分子有:_________(写出一种即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com