
【题目】如图所示,若电解5 min时,测得铜电极的质量增加2.16 g。试回答:

(1)电源中X极是________(填“正”或“负”)极。
(2)通电5 min时,B中共收集到224 mL(标准状况)气体,溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前c(CuSO4)=________。
(3)若A中KCl溶液的体积也是200 mL,电解后溶液中仍有Cl-,则电解后溶液的c(OH-)=________。
(4)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气合成为甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)===2H2O(l) ΔH=-570 kJ·mol-1 ①
2CH3OH(l)+ 3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1 ②
写出二氧化碳与氢气合成甲醇液体的热化学方程式:_________________________________。
【答案】 负 0.025 mol·L-1 0.1mol/L CO2(g)+3H2(g)===CH3OH(l)+H2O(l) ΔH=-129 kJ·mol-1
【解析】(1)由铜电极的质量增加,发生![]() ═Ag,则Cu电极为阴极,可以知道X为电源的负极;正确答案:负。
═Ag,则Cu电极为阴极,可以知道X为电源的负极;正确答案:负。
(2)C中阴极反应为![]() ═Ag,
═Ag,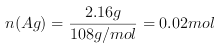 ,则转移的电子为
,则转移的电子为![]() ,B中阳极反应为
,B中阳极反应为![]() ═
═![]() ,则转移
,则转移![]() 电子生成氧气为
电子生成氧气为![]() ,其体积为
,其体积为![]() ,则在阴极也生成
,则在阴极也生成![]() 气体,由
气体,由![]() ═
═![]() ,则氢气的物质的量为
,则氢气的物质的量为![]() ,该反应转移的电子为
,该反应转移的电子为![]() ,则
,则![]() ═Cu中转移
═Cu中转移![]() 电子,所以
电子,所以![]() 的物质的量为
的物质的量为![]() ,通电前
,通电前![]() ;正确答案:
;正确答案:![]() 。
。
(3)由A中发生![]() ,由电子守恒可以知道,转移
,由电子守恒可以知道,转移![]() 电子时生成
电子时生成![]() ,忽略溶液体积的变化,则
,忽略溶液体积的变化,则![]() ,正确答案:0.1mol/L。
,正确答案:0.1mol/L。
(4)由①2H2(g)+O2(g)===2H2O(l) ΔH=-570 kJ·mol-1 ;②2CH3OH(l)+ 3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1;根据盖斯定律:(3×①-②)/2,可得:CO2(g)+3H2(g)===CH3OH(l)+H2O(l) ΔH=-129 kJ·mol-1;正确答案:CO2(g)+3H2(g)===CH3OH(l)+H2O(l) ΔH=-129 kJ·mol-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:____________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为___________,NaH2PO2___________ (填“能”或“不能”)与NaOH反应。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:____________________。
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
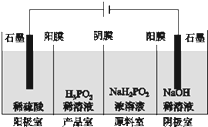
①写出阳极的电极反应式______________________________________________。
②分析产品室可得到H3PO2的原因______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。现用该浓硫酸配制450mL 1mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。

请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有______(选填序号),还缺少的仪器有______(写仪器名称);
(2)经计算,配制上述稀硫酸时需要用量筒量取上述浓硫酸的体积为______mL(保留一位小数)。
(3)接下来的操作是将上述所取浓硫酸进行稀释,稀释的操作是________________、__________________。
(4)在溶液配制过程中,下列操作会引起所配置硫酸的浓度偏低的有_________(填序号)
A.用量筒量取浓硫酸读数时仰视刻度线;
B.转移稀释的硫酸溶液后未洗涤烧杯和玻璃棒;
C.浓硫酸稀释后未经冷却即转移到容量瓶中;
D.容量瓶未干燥就用来配置溶液;
E.定容后摇匀溶液,发现液面低于刻度线,再加入少量水使液面与刻度线相平;
F.定容时仰视刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量铁粉加入到下列溶液中,铁粉溶解,但不产生气体和沉淀的是( )
A. 稀H2SO4溶液 B. FeCl3溶液 C. CuSO4溶液 D. NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是放热反应的是( )
A.Ba(OH)2·8H2O与NH4Cl的反应B.铝与稀盐酸的反应
C.灼热的碳与二氧化碳的反应D.氢氧化钠与盐酸的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A处通入潮湿的Cl2,关闭B阀时,C处干燥的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的不可能是( )
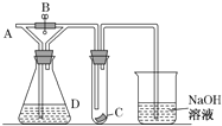
A. 浓H2SO4 B. NaOH溶液 C. 澄清石灰水 D. 饱和NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某主族元素R的最高正化合价与最低负化合价的代数和为4,由此可以判断( )
A.R一定是第四周期元素
B.R一定是ⅣA族元素
C.R的气态氢化物比同周期其他元素气态氢化物稳定
D.R气态氢化物化学式为H2R
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)6.02×1022个Na+ 的物质的量为_________________;
(2)标准状况下8.96L CO2的物质的量为_________________;
(3)在同温同压下,相同体积的O2和CH4,原子数目之比为______________;
(4)质量分数为98%的浓硫酸(溶液密度为1.84g/cm3)中H2SO4的物质的量浓度为__________;
(5)27.75 g某+2价金属的氯化物(MCl2)中含有3.01×1023个Cl-,则M的相对原子质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某溶液中由水电离产生的c(H+)等于10-13mol·L-1,该溶液的溶质不可能是( )
A. NaHSO4 B. NaCl C. HCl D. Ba(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com