
【题目】下列反应既是氧化还原反应,又是放热反应的是( )
A.Ba(OH)2·8H2O与NH4Cl的反应B.铝与稀盐酸的反应
C.灼热的碳与二氧化碳的反应D.氢氧化钠与盐酸的反应
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】下列有关环境污染的说法不正确的是( )
A. 燃煤时加入适量石灰石,可减少废气中SO2的量
B. pH在5.6~7之间的降水通常称为酸雨
C. 光化学烟雾的形成主要与NOx和碳氢化合物有关
D. 含磷洗涤剂会导致水体污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3molNH3分子中所含原子数与___________个H2O分子中所含原子数相等。
(2)含0.4molAl3+的Al2(SO4)3中所含的硫酸根离子的物质的量是___________。
(3)相同质量的SO2、SO3的物质的量之比为__________;氧原子的个数之比为_____________。
(4)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是_________;ACl2的化学式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌片和铜片用导线连接后放入稀硫酸溶液中,发生原电池反应,下列叙述错误的是( )
A.溶液的pH增大
B.锌片的质量减轻
C.溶液中的SO42﹣浓度增大
D.溶液的密度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
以有机物A 合成聚酯类高分子化合物F 的路线如下:

已知: 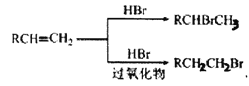
(1) A生成B 的反应类型为_________,C 中官能团的名称为__________ 。
(2) D 与NaOH 水溶液反应的化学方程式为__________ 。
(3) ①E 生成F 的化学方程式为__________。
②若F的平均相对分子质量为20000,则其平均聚合度为________ (填选项字母)。
A.54 B.108 C.119 D.133
(4) E 在一定条件下还可以合成含有六元环结构的G,G 的结构简式为__________。
(5) 满足下列条件的C 的同分异构体有___种(不考虑立体异构)。
①含有1个六元碳环,且环上相邻4 个碳原子上各连有一个取代基
②1mol 该物质与新制氢氧化铜悬浊液反应产生2mol 砖红色沉淀
(6) 写出以![]() 为原料(其他试剂任选) 制备化合物
为原料(其他试剂任选) 制备化合物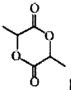 的合成路线,请用以下方式表示:
的合成路线,请用以下方式表示:  。___________________。
。___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若电解5 min时,测得铜电极的质量增加2.16 g。试回答:

(1)电源中X极是________(填“正”或“负”)极。
(2)通电5 min时,B中共收集到224 mL(标准状况)气体,溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前c(CuSO4)=________。
(3)若A中KCl溶液的体积也是200 mL,电解后溶液中仍有Cl-,则电解后溶液的c(OH-)=________。
(4)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气合成为甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)===2H2O(l) ΔH=-570 kJ·mol-1 ①
2CH3OH(l)+ 3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1 ②
写出二氧化碳与氢气合成甲醇液体的热化学方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是( )
A.铊是易导电的银白色金属
B.能生成+3价离子化合物
C.Tl(OH)3是两性氢氧化物
D.Tl3+的氧化能力比Al3+弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO46H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如下图:

已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
Ksp | 8.0×10—16 | 4.0×10—38 | 6.0×10—31 | 6.5×10—18 |
完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有 。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是 (用离子方程式表示);
加入NaOH调节pH的范围是 ,为了除去溶液中的 离子。
(3)滤液Ⅱ的主要成分是 。
(4)检验Ni2+已完全沉淀的实验方法是 。
(5)操作Ⅰ的实验步骤依次为:
① ;
② ;
③蒸发浓缩、冷却结晶,过滤得NiSO46H2O晶体;
④用少量乙醇洗涤NiSO46H2O晶体并晾干。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com