
【题目】下列各组离子一定能在指定环境中大量共存的是
A.在c(H+)=10-10 mol/L的溶液中 Al3+、NH![]() 、Cl-、NO
、Cl-、NO![]()
B.pH值为1的溶液 Fe2+、Na+ 、SO42-、NO![]()
C.水电离出来的c(H+)=10-12mol/L的溶液 K+、HCO3-、Cl-、ClO-
D.pH值为13的溶液 K+、CO![]() 、Na+、[Al(OH)]4-
、Na+、[Al(OH)]4-
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率________(填“增大”“减小”或“不变”)。
(2)已知几种化学键的键能数据如表(亚硝酰氯的结构式为Cl—N=O):
化学键 | NO | Cl—Cl | Cl—N | N=O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH=-111 kJ·mol-1,则a=________。
2ClNO(g) ΔH=-111 kJ·mol-1,则a=________。
(3)在1 L的恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图:
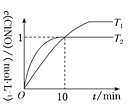
①从反应开始到10 min时NO的平均反应速率v(NO)=________mol·L-1·min-1。
②T2时该反应的平衡常数K=________。
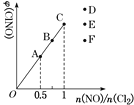
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图,则A、B、C三状态中,NO的转化率最大的是________点,当n(NO)/n(Cl2)=1.5时,反应达到平衡状态ClNO的体积分数可能是D、E、F三点中的________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是
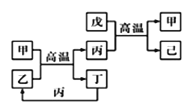
A.丙属于碱性氧化物
B.W元素在周期表中的位置是第四周期VIIIB族
C.W的原子序数是Z的两倍,金属性弱于Z
D.常温下等物质的量的甲和戊加入过量浓硝酸中,消耗的HNO3物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,我国古代的人民在那时候就已经广泛应用了相关的化学知识,古化文献中充分记载了古代化学研究成果。下列关于古代化学的应用和记载,对其说明不合理的是![]()
A.![]() 本草纲目
本草纲目![]() 中记载“
中记载“![]() 火药
火药![]() 乃焰消
乃焰消![]() 、硫磺、杉木炭所合,以烽燧铳机诸药者”,这是利用了“
、硫磺、杉木炭所合,以烽燧铳机诸药者”,这是利用了“![]() 的氧化性”
的氧化性”
B.李白有诗云“日照香炉生紫烟”,这是描写“碘的升华”
C.![]() 本草纲目
本草纲目![]() “烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上
“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上![]() 其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
D.我国古代人民常用明矾水除去铜器上的铜锈![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马日夫盐[Mn(H2PO4)2·2H2O]主要用作磷化剂;以软锰矿(主要成分为MnO2及少量的FeO、Al2O3和SiO2)为原料制备马日夫盐的主要工艺流程如图:
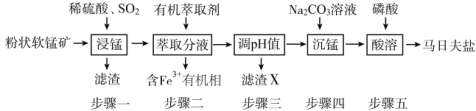
(1)按照无机物命名规律,马日夫盐[Mn(H2PO4)2·2H2O的化学名称为___。
(2)步骤一中,MnO2被SO2和___还原。若SO2气体中混有空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图,科研人员认为Mn2+对O2与H2SO3反应起催化作用,其理由是__。

(3)滤渣X主要成分为___;步骤三调节pH时,最适宜加入的物质是__。
A.过量稀盐酸 B.适量Na2CO3溶液
C.适量磷酸溶液 D.过量CaCO3
(4)在沉锰过程中,应将Na2CO3溶液逐量加入锰盐溶液中,如果颠倒试剂混合顺序会有Mn(OH)2生成,其原因是Na2CO3溶液具有较强__性;步骤五产生马日夫盐晶体的化学反应方程式为__。
(5)Fe3+的萃取率与溶液的pH和接触时间之间的关系如图,据此分析,萃取的最佳条件为____。
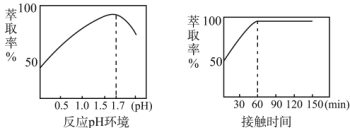
(6)马日夫盐作防锈磷化剂的原因是利用其较强的酸性以及在防锈处理过程中生成了具有保护作用的FeHPO4,马日夫盐显酸性的主要原因是__(用相关化学用语回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分子中有10个氢原子的烷烃的分子式是________________________________。
(2)已知下列三种有机物:
A.苯 B.乙醇 C.乙酸
回答下列问题
①写出苯的结构简式____________;
②能使紫色石蕊溶液变红的是____________(填字母代号);
③医疗上常用体积分数为75%的____________(填字母代号)作消毒剂;
④写出选取上述两种有机物在浓硫酸和加热条件下反应制备乙酸乙酯的化学方程式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温下氨水中存在如下平衡:NH3H2O![]() NH4++OH-,在5份0.01mol·L-1
NH4++OH-,在5份0.01mol·L-1
的氨水中分别加入下列各物质:A、浓氨水B、纯水C、少量NaOH固体D、少量浓硫酸E、NH4Cl固体,按照要求填空:
(1)电离平衡会向逆向移动是___。
(2)c(NH4+)、c(OH-)都增大的是___,升温时氨水的Kb将___(填“增大”、“减小”或“不变”)。
(3)c(NH4+)增大,c(OH-)减小的是___。
(4)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显___性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性废液含有H+、Fe3+、Ni2+、NO3—、F-和Cr2O72-等。下图是该废液的综合利用工艺流程:(假设: F—与金属离子的络合反应不影响其它反应和计算)
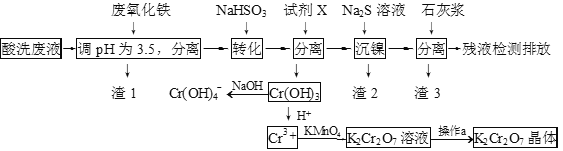
已知:金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
[Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
(1)滤渣1的主要成分为:____________。
(2)试剂X可以是足量氨水,还可以是:____________ 。(填序号)
A.Ni(OH)2 B.Cr2O3 C.Fe2O3 D.NaOH
(3)若试剂X是足量氨水,“沉镍”的离子方程式为:____________。
(4)经检测,最后的残液中c(Ca2+)=1.0×10─5 molL-1,则残液中F-浓度____________(填 “符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10 mgL─1]。
(5)镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
①某蓄电池反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
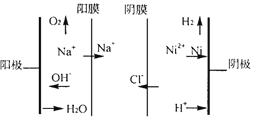
②图为双膜三室电解法处理含镍废水回收金属镍的原理示意图,阳极的电极反应式为____;电解过程中,需要控制溶液pH值为4左右,原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质的化学式:
胆矾_____________________ 铁红_____________________
苏打_____________________ 明矾__________________
(2)把SO2气体通入品红溶液中,现象为_____,将该溶液加热后,现象为________。把Cl2通入紫色石蕊试液中,现象为_____,将SO2通入紫色石蕊试液中,现象为______。
(3)工业上将氯气通入冷的消石灰[Ca(OH)2]中即制得漂白粉.写出该反应的化学方程式_____,在该反应中,氧化产物是_____(用化学式表示)。
(4)碳酸氢钠可用作治疗胃酸(主要含盐酸)过多的药剂,写出该反应的离子方程式________
(5)常用来作为潜水艇和呼吸面具中氧气来源的是_____________,它的颜色为______;
(6)在试管里放入一块铜片,注入一定体积的浓硫酸 ,给试管加热,使之反应。若铜片还有剩余,硫酸_______消耗完毕(填“已”或“没有”),其理由是_____________;继续向上述溶液中加入下列________物质,铜片会继续溶解。
A.KNO3 B.FeCl3 C.盐酸 D.氢氧化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com