
����Ŀ�����շ���[Mn(H2PO4)2��2H2O]��Ҫ���������������̿�(��Ҫ�ɷ�ΪMnO2��������FeO��Al2O3��SiO2)Ϊԭ���Ʊ����շ��ε���Ҫ����������ͼ��
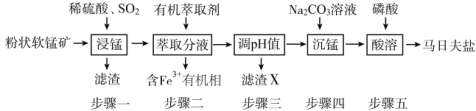
��1�����������������ɣ����շ���[Mn(H2PO4)2��2H2O�Ļ�ѧ����Ϊ___��
��2������һ�У�MnO2��SO2��___��ԭ����SO2�����л��п�������÷�ӦҺ��Mn2+��SO42����Ũ���淴Ӧʱ��t�仯��ͼ��������Ա��ΪMn2+��O2��H2SO3��Ӧ������ã���������__��

��3������X��Ҫ�ɷ�Ϊ___������������pHʱ�������˼����������__��
A������ϡ���� B������Na2CO3��Һ
C������������Һ D������CaCO3
��4���ڳ��̹����У�Ӧ��Na2CO3��Һ��������������Һ�У�����ߵ��Լ����˳�����Mn(OH)2���ɣ���ԭ����Na2CO3��Һ���н�ǿ__�ԣ�������������շ��ξ���Ļ�ѧ��Ӧ����ʽΪ__��
��5��Fe3+����ȡ������Һ��pH�ͽӴ�ʱ��֮��Ĺ�ϵ��ͼ���ݴ˷�������ȡ���������Ϊ____��
��6�����շ���������������ԭ�����������ǿ�������Լ��ڷ���������������˾��б������õ�FeHPO4�����շ��������Ե���Ҫԭ����__(����ػ�ѧ����ش�)��
���𰸡���ˮ����������� FeO Mn2+���ӵ�һ��Ũ�Ⱥ������Ũ��Ѹ������ �������� B �� MnCO3 + 2 H3PO4 + H2O = Mn(H2PO4)2��2H2O + CO2�� pH =1.7����ȡ60min H2PO4�� ![]() H+ + HPO42�������������������ˮ�⣬�����Һ������
H+ + HPO42�������������������ˮ�⣬�����Һ������
��������
�Ű��������������ɣ����շ���Mn(H2PO4)2��2H2O�Ļ�ѧ����Ϊ��ˮ����������̡�
�Ʋ���һ�У����̿��ж�����������������������������������ԭ��Ӧ�����MnO2��SO2��FeO��ԭ����SO2�����л��п�������÷�ӦҺ��Mn2+��SO42����Ũ���淴Ӧʱ��t�仯��ͼ������ͼ������ó��ڿ�ʼ�Σ������Ӻ��������ͬ����������������������������������ٶȿ죬���Mn2+��O2��H2SO3��Ӧ������á�
�Dz���һ����Ϊ����SiO2����������������ӣ�������������Ϊ��������������������pHʱ��Aѡ�����ϡ���ᣬ���ܵ���pH����Bѡ�����Na2CO3��Һ�����������ӣ�pH����Cѡ�����������Һ�����ܵ���pH����Dѡ�����CaCO3�����������ӣ�pH������������������ʣ����B��ȷ��
���ڳ��̹����У�Ӧ��Na2CO3��Һ��������������Һ�У�����ߵ��Լ����˳�����Mn(OH)2���ɣ���ԭ����Na2CO3��Һˮ�⣬��Һ���н�ǿ���ԣ�������������շ��ξ���Ļ�ѧ��Ӧ����ʽΪMnCO3 + 2 H3PO4 + H2O = Mn(H2PO4)2��2H2O + CO2����
��Fe3+����ȡ������Һ��pH�ͽӴ�ʱ��֮��Ĺ�ϵ��ͼ������ͼ����Ϣ�ó���ȡ���������ΪpH =1.7����ȡ60min��
�����շ���������������ԭ�����������ǿ�������Լ��ڷ���������������˾��б������õ�FeHPO4�����շ��������Ե���Ҫԭ����H2PO4�� ![]() H+ + HPO42�������������������ˮ�⣬�����Һ�����ԡ�
H+ + HPO42�������������������ˮ�⣬�����Һ�����ԡ�
�Ű��������������ɣ����շ���Mn(H2PO4)2��2H2O�Ļ�ѧ����Ϊ��ˮ����������̣��ʴ�Ϊ����ˮ����������̡�
�Ʋ���һ�У����̿��ж�����������������������������������ԭ��Ӧ�����MnO2��SO2��FeO��ԭ����SO2�����л��п�������÷�ӦҺ��Mn2+��SO42����Ũ���淴Ӧʱ��t�仯��ͼ������ͼ������ó��ڿ�ʼ�Σ������Ӻ��������ͬ����������������������������������ٶȿ죬���Mn2+��O2��H2SO3��Ӧ������ã��ʴ�Ϊ��FeO��Mn2+���ӵ�һ��Ũ�Ⱥ������Ũ��Ѹ������
�Dz���һ����Ϊ����SiO2����������������ӣ�������������Ϊ��������������������pHʱ��Aѡ�����ϡ���ᣬ���ܵ���pH����Bѡ�����Na2CO3��Һ�����������ӣ�pH����Cѡ�����������Һ�����ܵ���pH����Dѡ�����CaCO3�����������ӣ�pH������������������ʣ��ʴ�Ϊ������������B��
���ڳ��̹����У�Ӧ��Na2CO3��Һ��������������Һ�У�����ߵ��Լ����˳�����Mn(OH)2���ɣ���ԭ����Na2CO3��Һˮ�⣬��Һ���н�ǿ���ԣ�������������շ��ξ���Ļ�ѧ��Ӧ����ʽΪMnCO3 + 2 H3PO4 + H2O = Mn(H2PO4)2��2H2O + CO2�����ʴ�Ϊ���MnCO3 + 2 H3PO4 + H2O = Mn(H2PO4)2��2H2O + CO2����
��Fe3+����ȡ������Һ��pH�ͽӴ�ʱ��֮��Ĺ�ϵ��ͼ������ͼ����Ϣ�ó���ȡ���������ΪpH =1.7����ȡ60min���ʴ�Ϊ��pH =1.7����ȡ60min��
�����շ���������������ԭ�����������ǿ�������Լ��ڷ���������������˾��б������õ�FeHPO4�����շ��������Ե���Ҫԭ����H2PO4�� ![]() H+ + HPO42�������������������ˮ�⣬�����Һ�����ԣ��ʴ�Ϊ��H2PO4��
H+ + HPO42�������������������ˮ�⣬�����Һ�����ԣ��ʴ�Ϊ��H2PO4�� ![]() H+ + HPO42�������������������ˮ�⣬�����Һ�����ԡ�
H+ + HPO42�������������������ˮ�⣬�����Һ�����ԡ�


 ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ά����B3����ά������Ƥ�����������ܣ����Ҿ����������յĹ�Ч�����������Ԫ���Ľṹ�뱽�����ơ������й�ά����B���ӵ�˵���������
A.���е�̼ԭ�Ӿ�����ͬһƽ��B.����������Ϊͬ���칹��
C.��Ԫ���ϵ�һ�ȴ�����4��D.1mol�÷����ܺ�4mol H2�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ʊ�пӡˢ��·������ϡ���ḯʴп�壬�����ķ�Һ�����ð�Һ�������ð�Һ���г���������п�⣬����������ˮ�����Cl-��Fe3+����ʵ�����������ð�Һ����ȡznSO4��7H2O�Ĺ�������:
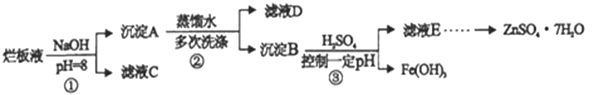
��1����ϡ���ḯʴп��ʱ��ԭ����ΪNH4NO3���������뻹ԭ�������ʵ���֮���� _________
��2��������ٵ�pH>12����Zn��OH��2�ܽ��������ǻ���п���ƣ�д��Zn��OH��2���ܽ�����ӷ���ʽ_____________
��3����ҺD�г��˺���OH��������,�����е���������_________�������ӷ��ţ���
��4������ҺE��pH=4, c��Zn2+��=2mol/L,c��Fe3+��=2.6��10-9mol/L����õ��ܶȻ���____����ѡ�
A Ksp��Zn��OH��2�� B Ksp��Zn��OH��2�ݺ�Ksp��Fe��OH��3�� C Ksp��Fe��OH��3��
��5����֪:��Fe��OH��3 ��s�� ![]() Fe3+��aq��+3OH-��aq�� ��H=a kJ/mol
Fe3+��aq��+3OH-��aq�� ��H=a kJ/mol
��H2O ��l�� ![]() H+��aq��+ OH-��aq�� ��H=b kJ/mol
H+��aq��+ OH-��aq�� ��H=b kJ/mol
��д��Fe3+����ˮ�ⷴӦ���Ȼ�ѧ����ʽ___________
��6����Fe��OH��3���ܶȻ�����ΪKsp��H2O �����ӻ�����ΪKw ��Fe3+����ˮ�ⷴӦ��ƽ�ⳣ��K=________�����ú�Ksp��Kw�Ĵ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() �й�ʫ�ʴ��
�й�ʫ�ʴ��![]() �����������л���ͳ�Ļ���ʫ���л��̺������ѧ֪ʶ�����з�����ȷ����
�����������л���ͳ�Ļ���ʫ���л��̺������ѧ֪ʶ�����з�����ȷ����![]()
A.�����ź�������ɽ��ɽ��������翼����ĺ�����¥��һ����Ȼ�����뽺��֪ʶ��
B.��ǧ�����������࣬������ɳʼ������˵����Ļ�ѧ�����ȶ�������Ȼ���г��Ե���״̬����
C.���ײ��������ɣ����������ƻ��������������̻���ijЩ��������ɫ��Ӧ�����ڻ�ѧ�仯
D.��������¯�����̣�ң���ٲ���ǰ�����е��������������ڿ����е�![]() �������
�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵����ȷ����
A. ��⾫��ͭʱת����NA�����ӣ������ܽ���32gͭ
B. 1mol FeCl3��ȫˮ��������NA��������������
C. �����£�1mol����ͨ������ˮ�з�����Ӧת�Ƶĵ�����ΪNA
D. 100mL 0.1mol/L Na2CO3��Һ�к��е���������Ŀ����0.01NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������һ������ָ�������д����������
A.��c(H+)=10-10 mol/L����Һ�� Al3+��NH![]() ��Cl����NO
��Cl����NO![]()
B.pHֵΪ1����Һ Fe2+��Na+ ��SO42-��NO![]()
C.ˮ���������c(H+)=10��12mol/L����Һ K+��HCO3-��Cl����ClO-
D.pHֵΪ13����Һ K+��CO![]() ��Na+��[Al(OH)]4��
��Na+��[Al(OH)]4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����298KʱK(HF)=3.5��10-4��Ksp(CaF2)=1.8��10-7
��HF(aq)![]() H+(aq)+F-(aq)��H<0
H+(aq)+F-(aq)��H<0
����������֪��Ϣ�ж�����˵����ȷ���ǣ� ��
A. 298Kʱ��������ˮϡ��HF��Һ�� ![]() ���ֲ���
���ֲ���
B. 308Kʱ��HF�ĵ��볣��Ka>3.5��10-4
C. 298Kʱ����CaF2��Һ�м�������CaCl2��Ksp(CaF2)���С
D. 2HF(aq)+Ca2+(aq)![]() CaF2(s)+2H+(aq)K��0.68
CaF2(s)+2H+(aq)K��0.68
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�ʰ���Ľṹ��ʽΪ![]() �����к��������ŵ�������____________����������____________�Ի����
�����к��������ŵ�������____________����������____________�Ի����
(2)����Ȳ��HCl���й��Լ���һ�������ºϳɾ�����ϩ���������£�
![]()
��ָ����Ӧ���ķ�Ӧ������____________��
��д����ӦI�Ļ�ѧ����ʽ________________________________
(3)1 mol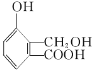 �������________________mol NaOH������Ӧ��
�������________________mol NaOH������Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���ѧ�����������ͻ���������ء������й�˵����ȷ����
A.ú��������Һ���������仯��ú�ĸ����ǻ�ѧ�仯
B.�Ҵ����������⡢�������Ƶ�����Һ�����Խ������������ﵽ������Ŀ��
C.����ȼ�ϵ�ط��磬������ֱ���ڿ�����ȼ�շ�������ת���ʸ�
D.�ϳɰ���ӦN2(g) +3H2(g)![]() 2NH3(g) ��H<0����������ܼӿ췴Ӧ���ʲ����ת����
2NH3(g) ��H<0����������ܼӿ췴Ӧ���ʲ����ת����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com