
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 电解精炼铜时转移了NA个电子,阳极溶解了32g铜
B. 1mol FeCl3完全水解后可生成NA个氢氧化铁胶粒
C. 常温下,1mol氯气通入足量水中发生反应转移的电子数为NA
D. 100mL 0.1mol/L Na2CO3溶液中含有的阴离子数目大于0.01NA
【答案】D
【解析】
A.电解精炼铜时每转移NA个电子,转移了1mol电子;由于粗铜中含有较活泼的杂质Fe、Zn等,电解时杂质优先放电,所以阳极溶解的铜小于0.5mol,溶解的铜的质量小于32g,故A错误;
B.氢氧化铁胶体是很多氢氧化铁胶粒的聚合体,所以1mol FeCl3完全水解生成氢氧化铁胶粒个数小于NA,故B错误;
C. 常温下,氯气和水反应为可逆反应,因此1mol氯气通入足量水中发生反应转移的电子数小于NA,故C错误;
D. 100mL 0.1mol/L Na2CO3溶液中,碳酸根离子少量水解:CO32-+H2O![]() HCO3-+OH-,阴离子增多,溶液中的阴离子数目大于0.01NA;故D正确;
HCO3-+OH-,阴离子增多,溶液中的阴离子数目大于0.01NA;故D正确;
综上所述,本题选D。


科目:高中化学 来源: 题型:
【题目】(1)已知:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 ;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH2,
则ΔH1______ΔH2;(填“> ”、“< ”或“=”)
(2)已知:H2(g)+Cl2(g)===2HCl(g)ΔH=-185 kJ·mol-1,查阅资料可知:H—H键能:436 kJ·mol-1、Cl—Cl键能:243 kJ·mol-1,则H—Cl键能=______________;
(3)在298K、100kPa时,已知:2H2(g)+O2(g)==2H2O(g) ΔH1 ;2HCl(g)==Cl2(g)+H2(g) ΔH2 ;2Cl2(g)+2H2O(g)==4HCl(g)+O2(g)ΔH3 , 则ΔH3与ΔH1和ΔH2的关系是:ΔH3=_______________;
(4)消除氮氧化物的污染对环境至关重要,用CH4催化还原NOx可以消除氮氧化物的污染。已知一定条件下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
则该条件下,用CH4还原NO2至N2的热化学方程式为:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100nL,Va、Vb与混合液的p的关系如图所示。下列说法正确的是

A. Ka(HA)=Kb(BOH)=1×10-6B. b点时,c(A-)=c(B+)=c(H+)=c(OH-)
C. c点时,c(A-)>c(B+)D. a→c过程中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析图,甲、乙具有的共性是
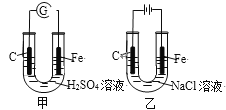
A. 反应物能量均高于生成物能量
B. 电极反应均有Fe-2e→Fe2+
C. 碳棒上均发生氧化反应
D. 溶液pH均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】净化汽车尾气对于保护环境意义重大。其中的一个反应原理为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)+Q(Q>0)。
N2(g)+2CO2(g)+Q(Q>0)。
回答下列问题:
(1)一定温度下,将等物质的量的NO和CO通入固定容积为4L的密闭容器中,反应过程中部分物质的物质的量变化如图所示,则0~20min平均反应速率v(NO)为_____________。

(2)如图所示,若Y表示平衡常数,只改变某一反应条件X,反应由平衡I达到新平衡Ⅱ,则条件X为_______________,NO的转化率为平衡I_________平衡Ⅱ(填:“大于”、“小于”或“不变”)

(3).能判断该反应达到平衡状态的标志是_______________(选填编号)
a.v生成(CO2)=v消耗(CO) b.混合气体的平均相对分子质量不再改变
c.平衡常数保持不变 d.NO、CO、N2、CO2的浓度均不再变化

(4).在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在上图中,补充画出从t2到t4时刻正反应速率随时间的变化曲线________ 。
(5).三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2,其反应分两步进行。第一步是:C3N3(OH)3![]() 3HCNO;第二步是HCNO与NO2反应,把氮元素和碳元素转变成无毒气体。请写出第二步发生的化学反应方程式______________________________________,每消除1mol NO2转移电子_________个。
3HCNO;第二步是HCNO与NO2反应,把氮元素和碳元素转变成无毒气体。请写出第二步发生的化学反应方程式______________________________________,每消除1mol NO2转移电子_________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示Na2CO3+2Cl2===2NaCl+Cl2O+CO2中的相关微粒,其中正确的是( )
A. Na+的结构示意图:![]()
B. Cl2O的结构式:Cl—O—Cl
C. 中子数比质子数多3的氯原子:3517Cl
D. CO2的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 甲醇燃料电池工作时,甲醇得到电子,发生还原反应
B. 室温下,稀释0.1 mol·L-1氨水,c(H+)·c(NH3·H2O)的值减小
C. 将1 mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2×6.02×1023
D. SiO2(s)+2C(s)===Si(s)+2CO(g)在常温下不能自发进行,则该反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]
8羟基喹啉(![]() )是白色或淡黄色粉末,可通过如下实验步骤制得:
)是白色或淡黄色粉末,可通过如下实验步骤制得:
①如图所示,在三颈烧瓶中加入适量甘油、邻硝基苯酚、邻氨基苯酚和浓硫酸。

②加热至反应自动激烈进行。
③改为水蒸气蒸馏装置进行水蒸气蒸馏,直至馏出液中不再有油珠为止。
④向三颈烧瓶中加入一定量NaOH溶液后,再滴加饱和Na2CO3溶液将pH调至7~8。
⑤重新进行水蒸气蒸馏,至馏出液中不再有晶体析出。
⑥将馏出液充分冷却后抽滤,进一步精制得产品。
(1)上图中冷却水应从________(填“A”或“B”)口进。

(2)上图是水蒸气发生装置。第一次水蒸气蒸馏的目的是___________________________________;当冷凝管出现堵塞时,图中可观察到的现象是_________________________________________。
(3)抽滤装置中,布氏漏斗进入抽滤瓶的部分不宜过长,其原因是________________________________。
(4)步骤②中移开火源,反应仍自动激烈进行的原因是__________________________________。
(5)步骤④中加入的饱和Na2CO3溶液不能过量的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(简称PFS或聚铁)是水处理中重要的絮凝剂。以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取聚合硫酸铁(![]() )的工艺流程如下:
)的工艺流程如下:
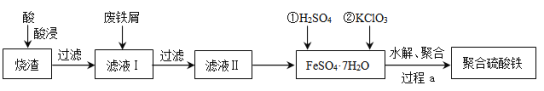
(1)酸浸时最合适的酸是_____(写化学式)。
(2)酸浸后溶液中主要的阳离子有_____。
(3)加入KClO3的目的是_____________________________(结合离子方程式说明)。
(4)过程a中生成聚合硫酸铁的过程是先水解再聚合。将下列水解反应原理的化学方程式补充完整。
_____Fe2(SO4)3+_____H2O![]() ______Fe2(OH)x(SO4)3-
______Fe2(OH)x(SO4)3-![]() + _____ ______
+ _____ ______
(5)过程a中水解要严控pH的范围。pH偏小或偏大聚合硫酸铁的产率都会降低,请解释原因__________。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,通常盐基度越高,絮凝效果越好。盐基度B的表达式:![]() (n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
(n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
ⅰ.取聚合硫酸铁样品m g,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应。然后以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V mL。
ⅱ.做空白对照实验,取与步骤ⅰ等体积等浓度的盐酸,以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0 mL。
①该聚合硫酸铁样品中n(OH-) =_________mol。
②已知该样品中Fe的质量分数w,则盐基度B=_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com