
【题目】(1)甘氨酸的结构简式为![]() ,其中含氧官能团的名称是____________,该物质是____________性化合物。
,其中含氧官能团的名称是____________,该物质是____________性化合物。
(2)以乙炔、HCl等有关试剂在一定条件下合成聚氯乙烯的流程如下:
![]()
①指出反应Ⅱ的反应类型是____________。
②写出反应I的化学方程式________________________________
(3)1 mol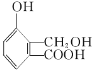 最多能与________________mol NaOH发生反应。
最多能与________________mol NaOH发生反应。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马日夫盐[Mn(H2PO4)2·2H2O]主要用作磷化剂;以软锰矿(主要成分为MnO2及少量的FeO、Al2O3和SiO2)为原料制备马日夫盐的主要工艺流程如图:
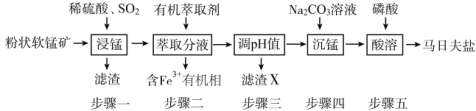
(1)按照无机物命名规律,马日夫盐[Mn(H2PO4)2·2H2O的化学名称为___。
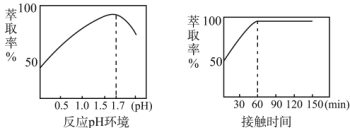
(2)步骤一中,MnO2被SO2和___还原。若SO2气体中混有空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图,科研人员认为Mn2+对O2与H2SO3反应起催化作用,其理由是__。

(3)滤渣X主要成分为___;步骤三调节pH时,最适宜加入的物质是__。
A.过量稀盐酸 B.适量Na2CO3溶液
C.适量磷酸溶液 D.过量CaCO3
(4)在沉锰过程中,应将Na2CO3溶液逐量加入锰盐溶液中,如果颠倒试剂混合顺序会有Mn(OH)2生成,其原因是Na2CO3溶液具有较强__性;步骤五产生马日夫盐晶体的化学反应方程式为__。
(5)Fe3+的萃取率与溶液的pH和接触时间之间的关系如图,据此分析,萃取的最佳条件为____。
(6)马日夫盐作防锈磷化剂的原因是利用其较强的酸性以及在防锈处理过程中生成了具有保护作用的FeHPO4,马日夫盐显酸性的主要原因是__(用相关化学用语回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温下氨水中存在如下平衡:NH3H2O![]() NH4++OH-,在5份0.01mol·L-1
NH4++OH-,在5份0.01mol·L-1
的氨水中分别加入下列各物质:A、浓氨水B、纯水C、少量NaOH固体D、少量浓硫酸E、NH4Cl固体,按照要求填空:
(1)电离平衡会向逆向移动是___。
(2)c(NH4+)、c(OH-)都增大的是___,升温时氨水的Kb将___(填“增大”、“减小”或“不变”)。
(3)c(NH4+)增大,c(OH-)减小的是___。
(4)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显___性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,发生反应:①M(s)+N(g) R(g) ΔH= - Q1 kJ/mol
②2 R(g)+N(g) 2T(g) ΔH= - Q2 kJ/mol(已知Q1、Q2、Q3均为正值)
下列说法正确的是
A. 1molR(g)的能量总和大于1molM(s)与1molN(g)的能量总和
B. 将2mol R(g)与1molN(g)充分混合,在一定条件下充分反应,放出热量Q2 kJ
C. 当1molM(s)完全转化为T(g)时(假定无热量损失),放出热量(Q1+0.5Q2)kJ
D. M(g)+N(g) R(g) ΔH= - Q3 kJ/mol,则Q3 < Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
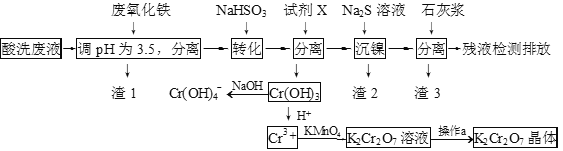
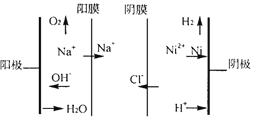
【题目】某酸性废液含有H+、Fe3+、Ni2+、NO3—、F-和Cr2O72-等。下图是该废液的综合利用工艺流程:(假设: F—与金属离子的络合反应不影响其它反应和计算)
已知:金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
[Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
(1)滤渣1的主要成分为:____________。
(2)试剂X可以是足量氨水,还可以是:____________ 。(填序号)
A.Ni(OH)2 B.Cr2O3 C.Fe2O3 D.NaOH
(3)若试剂X是足量氨水,“沉镍”的离子方程式为:____________。
(4)经检测,最后的残液中c(Ca2+)=1.0×10─5 molL-1,则残液中F-浓度____________(填 “符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10 mgL─1]。
(5)镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
①某蓄电池反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
②图为双膜三室电解法处理含镍废水回收金属镍的原理示意图,阳极的电极反应式为____;电解过程中,需要控制溶液pH值为4左右,原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料。将2.0 mol PCl3(g)和1.0 mol Cl2(g)充入体积不变的1L密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)![]() PCl5(g) △H<0,平衡时PCl5为0.4 mol,如果此时移走1.0 mol PCl3和0.5 molCl2,在相同条件下再达平衡时PCl5的物质的量是
PCl5(g) △H<0,平衡时PCl5为0.4 mol,如果此时移走1.0 mol PCl3和0.5 molCl2,在相同条件下再达平衡时PCl5的物质的量是
A.0.4molB.0.2molC.小于0.2molD.大于0.2mol,小于0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,K为开关,电极分别为Fe棒和C棒,电解质溶液为CuSO4溶液。
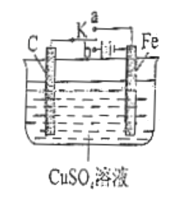
(1)当开关K置于a处时,该装置为________________(填“原电池”或 “电解池”)。写出Fe电极上的反应式____________________________。
(2)当开关K置于b处时,写出C电极上的反应式________________________。
(3)当开关K置于b处时,工作一段时间,当某电极上析出3.2g Cu时溶液的pH为____________。 (溶液的体积为1L) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法不正确的是

A. 装置A的作用是为实验提供持续不断的水蒸气
B. 装置B中反应的化学方程式是2Fe+3H2O![]() Fe2O3+3H2↑
Fe2O3+3H2↑
C. 装置C中加入的固体干燥剂可能是碱石灰
D. 点燃D处的气体前必须检验气体的纯度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com