
【题目】维生素B3可以维持身体皮肤的正常功能,而且具有美容养颜的功效,其分子中六元环的结构与苯环相似。下列有关维生素B分子的说法错误的是
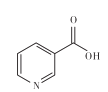
A.所有的碳原子均处于同一平面B.与硝基苯互为同分异构体
C.六元环上的一氯代物有4种D.1mol该分子能和4mol H2发生加成反应
科目:高中化学 来源: 题型:
【题目】按要求书写下列反应的方程式:
(1)NO2 溶于水的化学反应方程式:_____。
(2)实验室制取氨气的化学反应:_____。
(3)足量的 SO2 气体通入到 NaOH 中的离子反应方程式:______________。
(4)红热的碳和浓硝酸的化学反应方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是( )
A.已知:将Fe加入CuSO4 溶液中 Fe+ Cu2+= Cu + Fe2+
类推:将 Na加入 到CuSO4 溶液中2Na + Cu2+= Cu+2Na+
B.已知:稀硫酸与Ba(OH )2溶液反应至中性2H+ + SO4 2-+ Ba2++ 2OH- = BaSO4↓+ 2H2O
类推:NaHSO4 溶液与Ba(OH)2溶液反应至中性2H+ + SO4 2-+ Ba2++ 2OH- = BaSO4↓+ 2H2O
C.已知:铁和氯气反应2Fe + 3Cl2 ![]() 2FeCl3
2FeCl3
类推:铁和碘单质反应2Fe + 3I2 ![]() 2FeI3
2FeI3
D.已知:向Ca(ClO)2溶液中通入少量CO2:Ca2+ + 2ClO-+ CO2+ H2 O= CaCO3↓+2HClO
类推:向 Ca(ClO)2溶液中通入少量SO2:Ca2+ + 2ClO-+ SO2+ H2 O= CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化中蕴含着丰富的化学知识。下列![]() 天工开物
天工开物![]() 的记载中不涉及合金的是
的记载中不涉及合金的是![]()
![]()
A.凡铸镜,模用灰沙,铜用锡和
B.凡倭铅![]() 锌
锌![]() 古书本无之,乃近世所立名色。其质用炉甘石
古书本无之,乃近世所立名色。其质用炉甘石![]() 主要成分为碳酸锌
主要成分为碳酸锌![]() 熬炼而成
熬炼而成
C.凡釜储水受火,日用司命系焉。铸用生铁或废铸铁器为质
D.凡治地生物,用锄、镈之属,熟铁锻成,熔化生铁淋口,入水淬健,即成刚劲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 600 | 800 | 830 | 1000 | 1200 |
K | 0.25 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填“吸热”、“放热”)。反应达平衡后,若再通入一定量CO2,则平衡常数K将________,CO2的转化率________。(填“增大”、“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变 c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)若 600℃时,向容器中充入1mol CO、1mol H2O,反应达到平衡后,CO的转化率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率________(填“增大”“减小”或“不变”)。
(2)已知几种化学键的键能数据如表(亚硝酰氯的结构式为Cl—N=O):
化学键 | NO | Cl—Cl | Cl—N | N=O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH=-111 kJ·mol-1,则a=________。
2ClNO(g) ΔH=-111 kJ·mol-1,则a=________。
(3)在1 L的恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图:
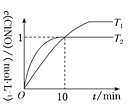
①从反应开始到10 min时NO的平均反应速率v(NO)=________mol·L-1·min-1。
②T2时该反应的平衡常数K=________。
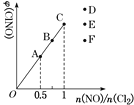
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图,则A、B、C三状态中,NO的转化率最大的是________点,当n(NO)/n(Cl2)=1.5时,反应达到平衡状态ClNO的体积分数可能是D、E、F三点中的________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬渣(铬主要以Cr2O3形式存在,同时含有Al2O3、SiO2等杂质)是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬产生的环境污染。铬渣综合利用工艺流程如下:
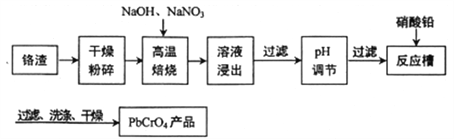
请回答下列问题:
(1)焙烧得到的产物含有Na2CrO4和一种无污染的气体,则生成Na2CrO4的反应方程式为________________________________________________________。
(2)除去铝元素的离子方程式为__________________________________________。
(3)理论上加入醋酸铅、硝酸铅均可以得到铬酸铅沉淀,工艺流程中不选用醋酸铅的原因是___________。
(4)铬酸铅是一种用于水彩和油彩的筑色颜料,遇到空气中的硫化物颜色会变黑,该过程的化学反应方程式为___________________________。
(5)实验室常利用Cr3+在碱性溶液中的还原性,使其转化为CrO42-,从而实现与Al3+的分离,这个过程中需要加入的两种试剂是__________、__________(填化学式),分离操作是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马日夫盐[Mn(H2PO4)2·2H2O]主要用作磷化剂;以软锰矿(主要成分为MnO2及少量的FeO、Al2O3和SiO2)为原料制备马日夫盐的主要工艺流程如图:
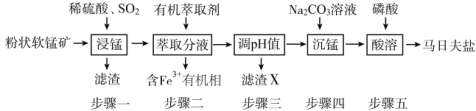
(1)按照无机物命名规律,马日夫盐[Mn(H2PO4)2·2H2O的化学名称为___。
(2)步骤一中,MnO2被SO2和___还原。若SO2气体中混有空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图,科研人员认为Mn2+对O2与H2SO3反应起催化作用,其理由是__。

(3)滤渣X主要成分为___;步骤三调节pH时,最适宜加入的物质是__。
A.过量稀盐酸 B.适量Na2CO3溶液
C.适量磷酸溶液 D.过量CaCO3
(4)在沉锰过程中,应将Na2CO3溶液逐量加入锰盐溶液中,如果颠倒试剂混合顺序会有Mn(OH)2生成,其原因是Na2CO3溶液具有较强__性;步骤五产生马日夫盐晶体的化学反应方程式为__。
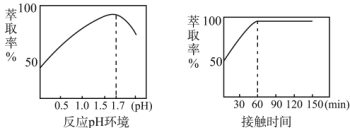
(5)Fe3+的萃取率与溶液的pH和接触时间之间的关系如图,据此分析,萃取的最佳条件为____。
(6)马日夫盐作防锈磷化剂的原因是利用其较强的酸性以及在防锈处理过程中生成了具有保护作用的FeHPO4,马日夫盐显酸性的主要原因是__(用相关化学用语回答)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com