
【题目】铬渣(铬主要以Cr2O3形式存在,同时含有Al2O3、SiO2等杂质)是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬产生的环境污染。铬渣综合利用工艺流程如下:
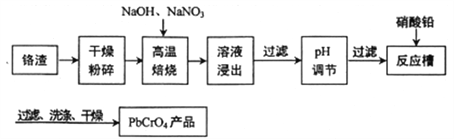
请回答下列问题:
(1)焙烧得到的产物含有Na2CrO4和一种无污染的气体,则生成Na2CrO4的反应方程式为________________________________________________________。
(2)除去铝元素的离子方程式为__________________________________________。
(3)理论上加入醋酸铅、硝酸铅均可以得到铬酸铅沉淀,工艺流程中不选用醋酸铅的原因是___________。
(4)铬酸铅是一种用于水彩和油彩的筑色颜料,遇到空气中的硫化物颜色会变黑,该过程的化学反应方程式为___________________________。
(5)实验室常利用Cr3+在碱性溶液中的还原性,使其转化为CrO42-,从而实现与Al3+的分离,这个过程中需要加入的两种试剂是__________、__________(填化学式),分离操作是_______________________。
【答案】5Cr2O3+14NaOH+6NaNO3 ==10Na2CrO4+3N2↑+7H2O AlO2-+H++H2O==Al(OH)3↓ 不引入新的杂质 PbCrO4+H2S==PbS+H2CrO4 NH3·H2O H2O2 过滤
【解析】
干燥粉碎铬渣(铬主要以Cr2O3形式存在,同时含有Al2O3、SiO2等杂质),加入NaOH、NaNO3,发生反应:5Cr2O3+14NaOH+6NaNO3![]() 10Na2CrO4+3N2↑+7H2O,浸出液含有NaOH、NaNO3、Na2CrO4、Na2SiO3、NaAlO2,除去不溶性杂质,加入硝酸调节pH,除去NaOH、Na2SiO3、NaAlO2,过滤,滤液为NaNO3、NaNO3、Na2CrO4,加入硝酸铅,得到铬酸铅沉淀,过滤、洗涤、干燥得产品,据此分析解答。
10Na2CrO4+3N2↑+7H2O,浸出液含有NaOH、NaNO3、Na2CrO4、Na2SiO3、NaAlO2,除去不溶性杂质,加入硝酸调节pH,除去NaOH、Na2SiO3、NaAlO2,过滤,滤液为NaNO3、NaNO3、Na2CrO4,加入硝酸铅,得到铬酸铅沉淀,过滤、洗涤、干燥得产品,据此分析解答。
(1)焙烧得到的产物含有Na2CrO4和一种无污染的气体氮气,则生成Na2CrO4的化学方程式为5Cr2O3+14NaOH+6NaNO3=10Na2CrO4+3N2↑+7H2O;
(2)氧化铝与氢氧化钠反应生成偏铝酸钠,通过调节pH转化为氢氧化铝沉淀,则除去铝元素的离子方程式为AlO2-+H++H2O=Al(OH)3↓;
(3)工艺流程中不选用醋酸铅的原因是不引入新的杂质;
(4)铬酸铅遇到空气中的硫化物颜色会变黑,说明有PbS产生,因此该过程的化学方程式为PbCrO4+H2S=PbS+H2CrO4;
(5)由于氢氧化铝能溶于强碱溶液中,NH3·H2O不会溶解氢氧化铝沉淀,所以加入NH3·H2O提供碱性环境,而且将Al3+转化为氢氧化铝沉淀;要转化为CrO42-,需要加入氧化剂,因此加入H2O2将Cr3+氧化为CrO42-,不会引人杂质,所以这个过程中需要加入的试剂是NH3·H2O、H2O2,分离操作是过滤。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示。下列说法错误的是( )
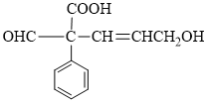
A.该有机物的分子式为C12H12O4
B.1 mol该有机物最多能与4 mol H2反应
C.该有机物可与NaHCO3溶液反应放出CO2,生成2.24 L CO2(标准状况下)需要0.1 mol该有机物
D.该有机物可发生氧化、取代、加成和还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素,a、b、c、d的原子序数依次增大。四种元素形成的单质依次为m、n、p、q;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol·L-1w溶液中,![]() 。上述物质的转化关系如图所示。下列说法正确的是
。上述物质的转化关系如图所示。下列说法正确的是
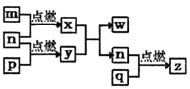
A. 原子半径的大小:a<b<c<d B. 氢化物的沸点:b>d
C. x的电子式为:![]() D. y、w含有的化学键类型完全相同
D. y、w含有的化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素B3可以维持身体皮肤的正常功能,而且具有美容养颜的功效,其分子中六元环的结构与苯环相似。下列有关维生素B分子的说法错误的是
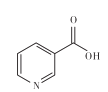
A.所有的碳原子均处于同一平面B.与硝基苯互为同分异构体
C.六元环上的一氯代物有4种D.1mol该分子能和4mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】布洛芬具有降温和抑制肺部炎症的双重作用。一种制备布洛芬的合成路线如下:
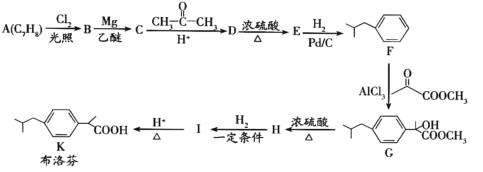
已知:①CH3CH2Cl![]() CH3CH2MgCl
CH3CH2MgCl![]()
![]()
②![]()
![]()
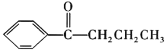 +HCl
+HCl
回答下列问题:
(1)A 的化学名称_____,G→H 的反应类型_____,H 中官能团的名称_________。
(2)分子中所有碳原子可能在同一平面上的 E 的结构简式_____。
(3)I→K 的化学方程式为_____。
(4)写出符合下列条件的 D 的同分异构体的结构简式_____ (不考虑立体异构)。
①能与 FeCl3溶液发生显色反应;
②分子中有一个手性碳原子;
③核磁共振氢谱有七组峰
(5)写出以间二甲苯、CH3COCl 和(CH3)2CHMgCl 为原料制备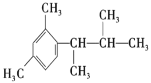 的合成路线________ (无机试剂任选)
的合成路线________ (无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠( Na2CO4)是一种很好的供氧剂,其与稀盐酸反应的化学方程式为:2Na2CO4+4HCl=4NaCl+2CO2 +O2+2H2O.市售过碳酸钠一般都含有碳酸钠,为测定某过碳酸钠样品(只含Na2CO4和Na2CO3)的纯度,某化学兴趣小组采用以下两种方案实施:
方案一:![]()
(1)操作①和③的名称分别为
(2)上述操作中,使用到玻璃棒的有 __(填操作序号)。
(3)请简述操作③的操作过程
方案二:按下图安装好实验装置,Q为一塑料气袋,随意取适量样品于其中,打开分液漏斗活塞,将稀盐酸滴入气袋中至充分反应。

(4)为测定反应生成气体的总体积,滴稀盐酸前必须关闭 ,打开 (填“K1”、“K2”或“K3”)。导管a的作用是 。
(5)当上述反应停止后,使K1、K3处于关闭状态,K2处于打开状态,再缓缓打开Kl。 B中装的固体试剂是 ,为何要缓缓打开K1? 。
(6)实验结束时,量筒I中有xmL水,量筒Ⅱ中收集到了ymL气体,则样品中过碳酸钠的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某一气态平衡体系中含有X、Y、Z、W四种气体物质,此温度下发生反应的平衡常数表达式为:![]() ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K增大 ,则正反应为吸热反应
B.增大压强,W质量分数增加
C.增大X浓度,平衡向正反应方向移动
D.升高温度,若混合气体的平均相对分子质量变大,则正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中除含有硝酸锌外,还含有自来水带入的Cl-和Fe3+。在实验室里用“烂板液”制取znSO4·7H2O的过程如下:
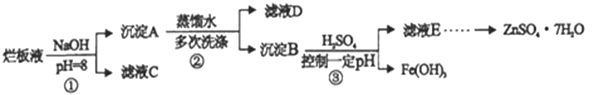
(1)若稀硝酸腐蚀锌板时还原产物为NH4NO3,氧化剂与还原剂的物质的量之比是 _________
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠,写出Zn(OH)2被溶解的离子方程式_____________
(3)滤液D中除了含有OH-离子外,还含有的阴离子有_________(填离子符号)。
(4)若滤液E的pH=4, c(Zn2+)=2mol/L,c(Fe3+)=2.6×10-9mol/L能求得的溶度积是____(填选项)
A Ksp[Zn(OH)2] B Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C Ksp[Fe(OH)3]
(5)已知:①Fe(OH)3 (s) ![]() Fe3+(aq)+3OH-(aq) △H=a kJ/mol
Fe3+(aq)+3OH-(aq) △H=a kJ/mol
②H2O (l) ![]() H+(aq)+ OH-(aq) △H=b kJ/mol
H+(aq)+ OH-(aq) △H=b kJ/mol
请写出Fe3+发生水解反应的热化学方程式___________
(6)若Fe(OH)3的溶度积常数为Ksp,H2O 的离子积常数为Kw ,Fe3+发生水解反应的平衡常数K=________。(用含Ksp、Kw的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①298K时K(HF)=3.5×10-4,Ksp(CaF2)=1.8×10-7
②HF(aq)![]() H+(aq)+F-(aq)△H<0
H+(aq)+F-(aq)△H<0
根据以上已知信息判断下列说法正确的是( )
A. 298K时,加蒸馏水稀释HF溶液, ![]() 保持不变
保持不变
B. 308K时,HF的电离常数Ka>3.5×10-4
C. 298K时,向饱和CaF2溶液中加入少量CaCl2,Ksp(CaF2)会减小
D. 2HF(aq)+Ca2+(aq)![]() CaF2(s)+2H+(aq)K≈0.68
CaF2(s)+2H+(aq)K≈0.68
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com