
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| 物质 | A | B | C | D |
| 起始投料(mol) | 2 | 1 | 2 | 0 |
| A. | 该反应的△H>0 | B. | 温度升高,该反应的平衡常数减小 | ||
| C. | 到达平衡时,n(B)=0.5 mol | D. | 平衡后,增加D的量,平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加入足量的高锰酸钾溶液,然后再加溴水 | |
| B. | 加入浓硫酸和浓硝酸后再加热 | |
| C. | 先加入足量的溴水,然后再加入高锰酸钾酸性溶液 | |
| D. | 点燃这种液体,然后再观察火焰的明亮程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的熔点较高 | B. | Z可以表示为M2Y | ||
| C. | Z可能易溶于水 | D. | M形成+2价的阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
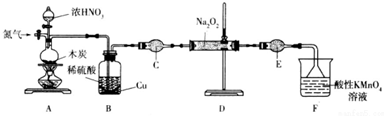
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
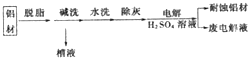
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
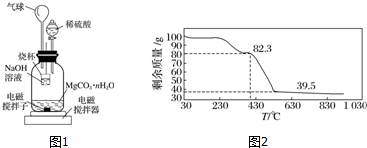
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
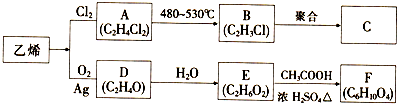
 .
.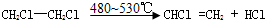 ;
;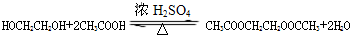 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com