
| 物质 | A | B | C | D |
| 起始投料(mol) | 2 | 1 | 2 | 0 |
| A. | 该反应的△H>0 | B. | 温度升高,该反应的平衡常数减小 | ||
| C. | 到达平衡时,n(B)=0.5 mol | D. | 平衡后,增加D的量,平衡逆向移动 |
分析 由起始D的物质的量为0可知,反应2A (g)+B(g)?2C(g)+D(s)向正反应进行建立平衡,正反应是气体体积减小的反应,容器的体积不变,而平衡时压强增大,说明在绝热条件下,混合气体的温度升高了,从而证明正反应为放热反应,其焓变△H<0,据此结合影响化学平衡的因素进行解答.
解答 解:起始时D的物质的量为0,则反应2A (g)+B(g)?2C(g)+D(s)只能向正反应进行建立平衡,正反应是气体体积减小的反应,又容器的体积不变,而平衡时压强增大,说明在绝热条件下,混合气体的温度升高了,则哎反应的正反应为放热反应,
A.根据分析可知,该反应为放热反应,则△H<0,故A错误;
B.该反应为放热反应,升高温度后平衡向着逆向移动,则该反应的平衡常数会减小,故B正确;
C.前10s内v(A)=0.025mol/(L•s),则前10s内v(B)=0.0125mol/(L•s),平衡时消耗B的物质的量为:0.0125mol/(L•s)×10s×2L=0.25mol,所以平衡时B的物质的量为:1mol-0.25mol=0.75mol,故C错误;
D.D为固体,平衡时增加D,平衡不发生移动,故D错误;
故选B.
点评 本题考查了化学平衡及其影响因素,题目难度中等,根据题干数据正确判断该反应为放热反应为解答关键,注意熟练掌握影响化学平衡的因素,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1•s-1,0.4 mol | B. | 0.2 mol•L-1•s-1,0.4 mol | ||
| C. | 0.2 mol•L-1•s-1,0.6 mol | D. | 0.4 mol•L-1•s-1,0.12 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
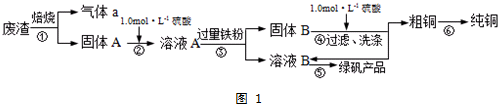
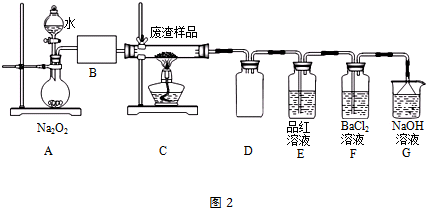
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:S2->Cl->Ca2+ | B. | 电负性:C>N>O | ||
| C. | 热稳定性:HF>H2O>H2S | D. | 酸性:HCl<HBr<HI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH3+中含有的电子数为10NA | |
| B. | 1mol铁粉与1mol水蒸气充分反应转移的电子数为3A | |
| C. | 0.1mol/L的Al2(SO4)3溶液中,Al3+的数目小于0.2NA | |
| D. | 电解精炼铜时,若转移了NA个电子,则阴极析出32g铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
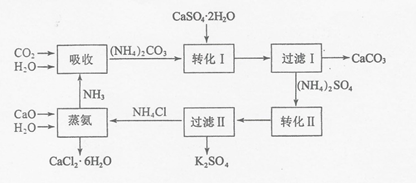
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
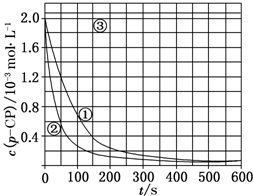 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | |||
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com