
【题目】(1)以下反应:①木炭与水制备水煤气②氯酸钾分解③炸药爆炸④酸与碱的中和反应⑤生石灰与水作用制熟石灰⑥Ba(OH)2·H2O与NH4Cl,属于放热反应__________(填序号),写出反应⑥的化学方程式______________。
(2)在下列化合物中: H2O2、Na2O、I2、NaCl、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
① 只由非金属组成的离子化合物是___________;
② 只有极性共价键的共价化合物是____________;
③ 只含有非极性共价键的是__________________;
④ 既有离子键又有非极性键的化合物是__________;
⑤ 写出NH4Cl的电子式______________;
⑥写出Na2O2的电子式______________。
(3)某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol/L的亚硫酸钠溶液,蓝色恰好完全褪去。
①写出实验①中发生反应的离子方程式:_______________________。
②实验②的化学反应中转移电子的物质的量是________________。
③以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是________。
【答案】(1)③④⑤;Ba(OH)2·H2O+2NH4Cl=BaCl2+2NH3+10H2O;
(2)①NH4Cl;②CO2;③I2;④Na2O2;⑤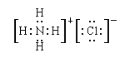 ;⑥
;⑥![]() ;
;
(3)①ClO-+2I-+2H+=I2+Cl-+H2O(2分);②0.004mol;③SO42-、I2、ClO-
【解析】
试题分析:(1)常见的放热反应有:所有的燃烧、所有的中和反应、金属和酸的反应、金属与水的反应、大多数化合反应、铝热反应等故放热反应的是③、④、⑤; 常见的吸热反应为:大多数的分解反应,氢氧化钡和氯化铵的反应、焦炭和二氧化碳、焦炭和水的反应等,所以吸热反应有:⑥,化学方程式:Ba(OH)28H2O+2NH4Cl=BaCl2 +2NH3↑+10H2O,故答案为:③④⑤;Ba(OH)28H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;
(2)①铵盐是全部由非金属元素组成的离子化合物,符合条件的是氯化铵,故答案为:NH4Cl;
②只含共价键的化合物是共价化合物,不同非金属元素之间易形成极性共价键,只有极性键构成的共价化合物为CO2,故答案为:CO2;
③同种非金属元素之间形成非极性共价键,符合条件的是I2,故答案为:I2;
④活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性共价键,则符合条件的是Na2O2,故答案为:Na2O2。
⑤NH4Cl的电子式为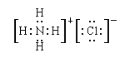 ,故答案为:
,故答案为: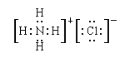 ;
;
⑥Na2O2的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)①实验①说明酸性条件下,次氯酸钠把碘离子氧化生成碘单质,同时自身被还原生成氯离子,该反应中,次氯酸根离子得电子作氧化剂,碘离子失电子是还原剂,氧化产物是碘,所以氧化性强弱为:ClO->I2,反应离子方程式为:ClO-+2I-+2H+=I2+Cl-+H2O,故答案为:ClO-+2I-+2H+=I2+Cl-+H2O;
②实验②说明碘单质把亚硫酸根离子氧化生成硫酸根离子,自身被还原生成碘离子,氧化剂是碘,还原剂是亚硫酸钠,氧化产物是硫酸根离子,所以氧化性强弱为:I2>SO42-,反应离子方程式为:H2O + I2 + SO32- = SO42- + 2I- + 2H+,设转移电子的物质的量为x。
H2O+SO32-+I2=SO42-+2I-+2H+ 转移电子
1mol 2mol
0.5mol/L×0.004L x
x=![]() =0.004mol,故答案为:0.004 mol;
=0.004mol,故答案为:0.004 mol;
③实验①说明氧化性强弱为:ClO->I2,实验②说明氧化性强弱为:I2>SO42-,所以在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是SO42-、I2、ClO-,故答案为:SO42-、I2、ClO-。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】由NaHS、MgSO4、NaHSO3组成的混合物中,已知S元素的质量分数w(S)=a%,则O元素的质量分数w(O)为
A. 1-1.75a% B. 1.75a% C.1.25a% D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依照“同温、同压、同体积的任何气体所含分子数相同”,下列叙述正确的是( )
A.同温、同压下两种气体的体积之比等于摩尔质量之比
B.同温、同压下两种气体的物质的量之比等于密度之比
C.同温、同压下两种气体的质量之比等于密度之反比
D.同温、同体积下两种气体的物质的量之比等于压强之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种很重要的金属,可以发生一系列反应制备物质。
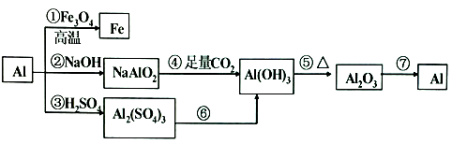
回答下列问题:
(1)反应①可以用于____________(说出一条)。
(2)②③反应产生等量氢气消耗的NaOH与H2SO4的物质的量之比为_______。
(3)反应④的离子反应的方程式为__________________。
(4)用反应⑥制备Al(OH)3,最好是向A12(SO4)3溶液中滴加______,离子方程式为________。
(5)工业上常用反应⑦制备金属铝,制备过程的方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有14.4 gCO和CO2的混合气体,在标准状况下,其体积为8.96L。回答下列问题:
(1)该混合气体的平均摩尔质量为__________。
(2)混合气体中碳原子的个数为________(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如下图所示装置,剩余气体最后收集在气球中(实验在标准状况下测定)。

气球中收集到的气体的摩尔质量为__________。
气球中收集到的气体中,电子总数为____________(用NA表示阿伏加德罗常数的值)。
气球的体积为____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中:
A.2F2+2H2O=4HF+O2
B.2Na+2H2O=2NaOH+H2↑
C.3NO2+H2O=2HNO3+NO
D.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
其中水只作氧化剂的是________________,水只作还原剂的是________________,水既作氧化剂又作还原剂的是______________,水既不作氧化剂又不作还原剂的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VL 浓度为1mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是
A.通入标准状况下的HC1气体22.4VL
B.将溶液加热浓缩到0.5VL
C.加入10mol·L-1的盐酸0.2VL,再稀释至1.5VL
D.加入VL3mol·L-1的盐酸混合均匀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com