
| A. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在:c (Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol/L:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 常温下,将0.1 mol/L CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液的Kac(H+)值减小到原来的$\frac{1}{10}$ |
分析 A.根据硫化钠溶液中的质子守恒可得;
B.pH为1的0.1 mol/L HA溶液,说明HA为强电解质,则二者混合恰好反应生成强碱弱酸盐NaA,溶液呈中性;
C.常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol/L,则c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-)=O.1mol/l;
D.稀释后氢离子浓度变为原先的$\frac{1}{10}$,结合醋酸的电离平衡常数表达式分析$\frac{{k}_{a}}{c({H}^{+})}$的变化.
解答 解:A.任何电解质溶液中都存在质子守恒,根据硫化钠溶液中的质子守恒得:c(OH-)=c(H+)+c(HS-)+2c(H2S),故A错误;
B.常温下,0.1 mol/L HA溶液的pH为1,说明HA为强酸,则该HA溶液与0.1 mol/L NaOH溶液恰好完全反应时生成强酸强碱盐NaA,溶液为中性,则溶液中一定满足::c (Na+)=c(A-)>c(OH-)=c(H+),故B正确;
C.CH3COONa和CH3COOH混合溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-)=O.1mol/L,则溶液中正确的离子浓度大小为:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-),故C错误;
D.根据醋酸的电离平衡常数表达式可知:$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{{k}_{a}}{c({H}^{+})}$,当溶液的pH从3.0升到4.0时,溶液中氢离子浓度减小为原先的$\frac{1}{10}$,由于温度不变,醋酸的电离平衡常数不变,则$\frac{{k}_{a}}{c({H}^{+})}$的值增大为原先的10倍,故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒、盐的水解原理的含义为解答关键,试题侧重考查学生的分析、理解能力,D为易错点,需要根据平衡常数的表达式进行转化.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:选择题
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 | |
| C. | 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后反应速率加快 | |
| D. | 烧过菜的铁锅加入清水放置,出现红棕色的锈斑 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
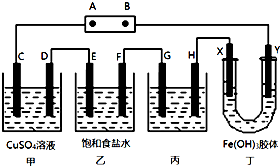 某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、三氧化钨、铁片和木炭粉9种物质中,存在下面的相互关系,选择①~⑤为适当的物质,使有连线的两种物质能发生反应.
在稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、三氧化钨、铁片和木炭粉9种物质中,存在下面的相互关系,选择①~⑤为适当的物质,使有连线的两种物质能发生反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com