
下列物质中,在一定条件下能与醋酸发生反应的是( )
①食盐 ②乙醇 ③氢氧化铜 ④金属铝 ⑤氧化镁 ⑥碳酸钙
A.①③④⑤⑥ B.②③④⑤⑥ C.①②④⑤⑥ D.全部
科目:高中化学 来源: 题型:
合成氨反应为3H2+N2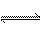 2NH3,其反应速率可以分别为v(H2)、v(N2)、v(NH3)[mol·(L·s)-1]表示,则正确的关系式为( )
2NH3,其反应速率可以分别为v(H2)、v(N2)、v(NH3)[mol·(L·s)-1]表示,则正确的关系式为( )
A.v(H2)=v(N2)=v(NH3) B.3v(H2)=v(N2)
C.v(NH3)=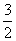 v(H2) D.v(H2)=3v(N2)
v(H2) D.v(H2)=3v(N2)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知难溶于水的盐在水中存在溶解平衡,例如氯化银在水中的溶解平衡为AgCl(s) Ag++Cl-
Ag++Cl-
在一定温度下,水溶液中银离子(Ag+)和氯离子(Cl-)的物质的量浓度的乘积为一常数,可用Ksp表示:Ksp=c(Ag+)·c(Cl-)=1.8×10-10
现把氯化银(足量)分别放入:①100 mL蒸馏水中;②100 mL0.1 mol/L盐酸溶液中;③1 000 mL0.1 mol/L的氯化铝溶液中;④100 mL 0.01 mol/L的氯化镁溶液中,充分搅拌后,相同温度下,银离子浓度由大到小的顺序是(用序号回答)________________________。
在0.1 mol/L氯化铝溶液中,银离子的物质的量浓度最大可达到__________mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
已知可逆反应:M(g)+N(g)P(g)+Q(g)
ΔH>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol/L,c(N)=2.4 mol/L;达到平衡后,M的转化率为60%,此时N的转化率为__________;
(2)若反应温度升高,M的转化率__________(填“增大”、“减小”或“不变”);
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=4 mol/L,c(N)=a mol/L;达到平衡后,c(P)=2 mol/L,a=______。
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol/L;达到平衡后,M的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是六种常见有机化合物分子的球棍模型,下列有关叙述中不正确的是
A.甲、乙、丙属于烃,丁、戊、己属于烃的衍生物
B.丙和己混合后会分层,且丙在上层
C.甲、丙、丁、戊、己均发生取代反应
D.乙和水反应可生成丁,丁和戊反应可生成己

查看答案和解析>>
科目:高中化学 来源: 题型:
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是______________________。
(2) X与空气中的氧气在铜或银催化下反应生成Y,Y的结构式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
中国环境监测总站数据显示,颗粒物(PM2.5)是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx 等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为试样的pH=______。
(2)NOx 汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: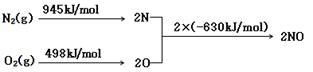
则反应N2(g)+O2(g) 2NO(g)
2NO(g) 
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
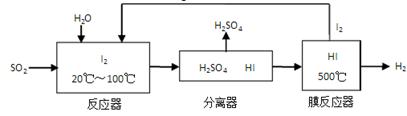
①用离子方程式表示反应器中发生的反应:__________________________。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是_______。
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:NiO(OH)2+M NiO(OH)+MH,电池放电时,负极的电极反应式________________________________;充电完成时,Ni(OH)2全部转化为NiO(OH),若继续充
NiO(OH)+MH,电池放电时,负极的电极反应式________________________________;充电完成时,Ni(OH)2全部转化为NiO(OH),若继续充 电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电池反应式为______________。
电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电池反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
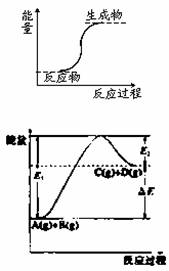
下列反应属于放热反应的是
A.能量变化如图所示的反应
B.燃烧反应和铝热反应
C.化学键断裂吸收的热量比化学键生成放出的热量多的反应
D.氢氧化钡晶体和氯化铵晶体的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com