
中国环境监测总站数据显示,颗粒物(PM2.5)是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx 等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为试样的pH=______。
(2)NOx 汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: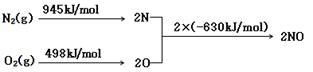
则反应N2(g)+O2(g) 2NO(g)
2NO(g) 
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
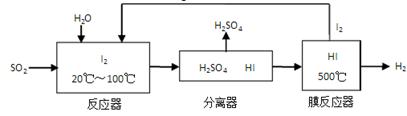
①用离子方程式表示反应器中发生的反应:__________________________。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是_______。
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:NiO(OH)2+M NiO(OH)+MH,电池放电时,负极的电极反应式________________________________;充电完成时,Ni(OH)2全部转化为NiO(OH),若继续充
NiO(OH)+MH,电池放电时,负极的电极反应式________________________________;充电完成时,Ni(OH)2全部转化为NiO(OH),若继续充 电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电池反应式为______________。
电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电池反应式为______________。
【知识点】PH的计算,化学反应中的能量变化, 化学电源新型电池 F5
【答案解析】(1)4(2分)
(2)+183kJ·mol-1(2分)
(3)①SO2+I2+2H2O=SO42-+2I-+4H+(2分)
②HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行(1分)
③MH+OH--e-=H2O+M;O2+4e-+2H2O=4OH-(各2分)
解析:(1)溶液中电荷守恒:C(K+)+C(NH4+)+C(H+)=2C(SO42-)+C(NO3-)+C(Cl-),得C(H+)=1×10-4mol•L-1,pH值为4。
(2)①该反应中的反应热=反 应物的键能和-生成物的键能和=(945+498)kJ/mol-2×630kJ/mo
应物的键能和-生成物的键能和=(945+498)kJ/mol-2×630kJ/mo l
l
=+183kJ/mol。
(3)②在膜分离器中发生反应:2HI⇌I2+H2,将H2分离出来有利于平衡向右移动,利于I2和H2的生成;③负极反应物MH失去电子,生成的H+在碱性条件下生成H2O,电极反应式为:MH-e-+OH-=H2O+M,阴极的电极反应有两个,第一阶段是充电时的反应式,阴极上电极反应式为M+H2O+e-═MH+OH-,第二阶段为吸收氧气的电解反应式,由题意知氧气在阴极上被还原,电解质溶液呈碱性可知氧气被还原为OH-,所以其电极反应式为2H2O+O2+4e-═4OH-。
【思路点拨】该题综合考查化学反应原理的基础知识,涉及原电池和电解池原理、化学反应与能量变化以及化学平衡等问题,明确正负极、阴阳极上得失电子是解本题关键,难点是电极反应式的书写,电极反应式要结合溶液的酸碱性书写,为易错点。


科目:高中化学 来源: 题型:
如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )

A.a中铁钉附近呈现红色
B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应
D.b中铝丝附近有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中,在一定条件下能与醋酸发生反应的是( )
①食盐 ②乙醇 ③氢氧化铜 ④金属铝 ⑤氧化镁 ⑥碳酸钙
A.①③④⑤⑥ B.②③④⑤⑥ C.①②④⑤⑥ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
三氯异氰尿酸(结构简式如图)是养蚕业和水产养殖业最重要的消毒剂,三氯异氰尿酸水解生成X和NH4HCO3。下列关于X的说法不正确的是

A.X的结构式为H—Cl—O B.X有强氧化性
C.X属于弱酸 D.X属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足图示转化关系的是


A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
硼是一种重要的非金属元素,单质硼可以通过硼镁矿(主要成分为Mg2B2O5·H2O)来制取。
第①步:将硼镁矿用NaOH浓溶液溶解,过滤得NaBO2溶液
第②步:将NaBO2 浓缩后通入CO2调节碱度,结晶析出硼砂Na2B4O7·10H2O
第③步:将硼砂溶于水后,用H2SO4调节碱度,过滤得H3BO3 晶体
第④步:加热硼酸使之脱水生成B2O3。
第⑤步:B2O3用镁还原即得粗单质硼。
请回答下列问题:
(1)已知H3BO3 分子中只含B—O键和O—H键,则H3BO3 的结构式为___________。
(2)第①步反应的化学方程式为_______________________________________;
第③步反应的离子方程式为____________________________________________。
(3)制得的粗硼在一定条件下反应全部化成BI3,然后BI3热分解可以得到纯净的单质硼。由0.25g粗硼制成的BI3分解得到I2全部被收集后,用1.80mol·L-1的Na2S2O3溶液滴定,用去35.00mLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O52-)
①盛装Na2S2O3溶液的为____________(填“酸式”或“碱式”)滴定管,滴定过程中所用的指示剂为________________。
②粗硼中硼的含量为__ ________________。
________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、SCN-、Br-可以大量存在
B.和KI溶液反应的离子方程式: Fe3++2I- =Fe2++I2
C.和Ba(OH)2溶液反应离子方程式:Fe3++ SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓
D. 1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列说法正确的是 ( )
A、30 g SiO2含有NA个Si-O共价键
B、1 L 0.2mol·L-1 Al2(SO4)3溶液中的离子总数为NA
C、标准状况下,22.4 L H2O所含原子个数大于3NA
D、含4 mol HCl的浓盐酸跟足量MnO2加热反应可制得Cl2的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
冰箱制冷剂氟氯甲烷在高空中受紫外线辐射产生Cl原子,并进行下列反应:Cl+O3 ClO+O2,ClO+O
ClO+O2,ClO+O Cl+O2。下列说法不正确的是( )
Cl+O2。下列说法不正确的是( )
A.反应后将O3转变为O2 B.Cl原子是总反应的催化剂
C.氟氯甲烷是总反应的催化剂 D.Cl原子反复起分解O3的作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com