
冰箱制冷剂氟氯甲烷在高空中受紫外线辐射产生Cl原子,并进行下列反应:Cl+O3 ClO+O2,ClO+O
ClO+O2,ClO+O Cl+O2。下列说法不正确的是( )
Cl+O2。下列说法不正确的是( )
A.反应后将O3转变为O2 B.Cl原子是总反应的催化剂
C.氟氯甲烷是总反应的催化剂 D.Cl原子反复起分解O3的作用
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
中国环境监测总站数据显示,颗粒物(PM2.5)是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx 等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为试样的pH=______。
(2)NOx 汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: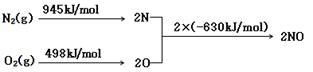
则反应N2(g)+O2(g) 2NO(g)
2NO(g) 
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
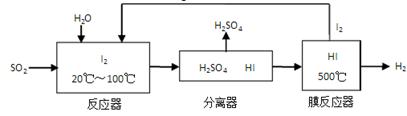
①用离子方程式表示反应器中发生的反应:__________________________。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是_______。
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:NiO(OH)2+M NiO(OH)+MH,电池放电时,负极的电极反应式________________________________;充电完成时,Ni(OH)2全部转化为NiO(OH),若继续充
NiO(OH)+MH,电池放电时,负极的电极反应式________________________________;充电完成时,Ni(OH)2全部转化为NiO(OH),若继续充 电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电池反应式为______________。
电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电池反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于放热反应的是
A.能量变化如图所示的反应
B.燃烧反应和铝热反应
C.化学键断裂吸收的热量比化学键生成放出的热量多的反应
D.氢氧化钡晶体和氯化铵晶体的反应
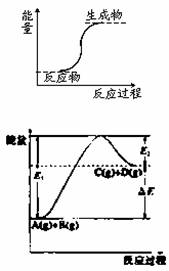
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中a曲线表示一定条件下可逆反应
X(g)+Y(g)====2Z(g)+W(s) △H<0的反应过程。若使a曲线变为b曲线,可采用的措施是
A.升高温度 B.增大Y的浓度
C.降低温度 D.增大体系压强
查看答案和解析>>
科目:高中化学 来源: 题型:
⑴ 由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式: _ 。
若1g水蒸气转化成液态水放热2.444kJ,则氢气的燃烧热为_____________。
⑵已知① CO(g) + 1/2 O2(g) = CO2(g) ; ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) = H2O(l) ; ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l); ΔH3=-1370 kJ/mol
试写出一氧化碳与氢气反应生成液态水和乙醇液体的热化学方程式:
___________________________________________________________。
(3)Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K,测得在不同
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K,测得在不同
温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
①若500℃时进行反应,CO2起始浓度为2 mol·L-1,CO的平衡浓度为________。
②此反应焓变中的a________0(填大于、小于、等于)。
查看答案和解析>>
科目:高中化学 来源: 题型:
100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量6 mol·L-1的盐酸 B.加入少量醋酸钠固体
C.加热 D.加入少量金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
有一化学反应:aA+bB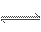 C,根据影响化学反应速率的因素可得v0=kcm(A)cn(B),其中k是与温度有关的常数,为测得k、m、n的值,在298 K时,将A、B溶液按不同浓度混合,得到下表中的实验数据:
C,根据影响化学反应速率的因素可得v0=kcm(A)cn(B),其中k是与温度有关的常数,为测得k、m、n的值,在298 K时,将A、B溶液按不同浓度混合,得到下表中的实验数据:
| 编号 | A的初 | B的初 | 生成C的 |
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 4.0 | 1.0 | 4.9×10-2 |
| 4 | 1.0 | 1.0 | 1.2×10-2 |
| 5 | 1.0 | 2.0 | 4.8×10-2 |
| 6 | 1.0 | 4.0 | 1.9×10-1 |
(1)依表中数据可求得m=___________,n=___________,k=___________,k的单位是___________。
(2)若a=m,b=n,当c(A)=c(B)=2.0 mol·L-1时,求以B表示的初始反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,将22.4 L HCl完全溶于1 L水中(水的密度近似为1 g/mL),溶液的密度为ρ g/cm3,溶液的体积为V mL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
①w=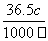 ×100% ②c=1 mol·L-1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w ④所得溶液中含有NA个HCl分子
×100% ②c=1 mol·L-1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w ④所得溶液中含有NA个HCl分子
A.全部 B.①③④ C.①③ D.只有①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com