
100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量6 mol·L-1的盐酸 B.加入少量醋酸钠固体
C.加热 D.加入少量金属钠
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
硼是一种重要的非金属元素,单质硼可以通过硼镁矿(主要成分为Mg2B2O5·H2O)来制取。
第①步:将硼镁矿用NaOH浓溶液溶解,过滤得NaBO2溶液
第②步:将NaBO2 浓缩后通入CO2调节碱度,结晶析出硼砂Na2B4O7·10H2O
第③步:将硼砂溶于水后,用H2SO4调节碱度,过滤得H3BO3 晶体
第④步:加热硼酸使之脱水生成B2O3。
第⑤步:B2O3用镁还原即得粗单质硼。
请回答下列问题:
(1)已知H3BO3 分子中只含B—O键和O—H键,则H3BO3 的结构式为___________。
(2)第①步反应的化学方程式为_______________________________________;
第③步反应的离子方程式为____________________________________________。
(3)制得的粗硼在一定条件下反应全部化成BI3,然后BI3热分解可以得到纯净的单质硼。由0.25g粗硼制成的BI3分解得到I2全部被收集后,用1.80mol·L-1的Na2S2O3溶液滴定,用去35.00mLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O52-)
①盛装Na2S2O3溶液的为____________(填“酸式”或“碱式”)滴定管,滴定过程中所用的指示剂为________________。
②粗硼中硼的含量为__ ________________。
________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
影响化学反应速率的因素有多方面,如浓度。压强。温度。催化剂等。下列有关说法不正确的是
A.改变压强能改变气体反应的速率
B.增大浓度能加快化学反应速率,原因是增大浓度就增加了反应体系中活化分子的百分数
C.温度升高使化学反应速率加快的主要原因是增加了反应体系中活化分子的百分数
D.催化剂能加快化学反应速率主要原因是降低反应所需的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
反应aM(g)+bN(g)  cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是( )
cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是( )
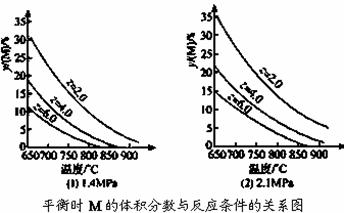
A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加
B.同压同z时,升高温度,平衡时Q的体积分数增加
C.同温同z时,增加压强,平衡时Q的体积分数增加
D.同温同压时,增加z,平衡时Q的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
冰箱制冷剂氟氯甲烷在高空中受紫外线辐射产生Cl原子,并进行下列反应:Cl+O3 ClO+O2,ClO+O
ClO+O2,ClO+O Cl+O2。下列说法不正确的是( )
Cl+O2。下列说法不正确的是( )
A.反应后将O3转变为O2 B.Cl原子是总反应的催化剂
C.氟氯甲烷是总反应的催化剂 D.Cl原子反复起分解O3的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
在25 ℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.6 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末收集到氢气1.12 L(已换算为标准状况),在此之后,又经过4 min,铁粉完全溶解。求:
(1)在前2 min内用FeCl2表示的平均反应速率;
(2)在后4 min内用HCl表示的平均反应速率;
(3)前2 min与后4 min相比,反应速率哪个较快?
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米材料”(1 nm=10-9m )是指研究开发直径为几纳米至几十纳米的材料。如将“纳米材料”分散到某液体中,对于所得分散系的叙述不正确的是
A.光束通过此分散系时会形成一条光亮的“通路”
B.此分散系中“纳米材料”的粒子在做不停的、无序的运动
C.用滤纸过滤的方法可以从此分散系中分离得到该“纳米材料”
D.在外加电场作用下,“纳米材料”的粒子可能向某一极做定向运动
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填空:
(1)某溶液中只含有K+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑,回答下列问题:
①该反应中的氧化剂是_______________。
②用单线桥表示此反应转移的电子数目及方向。
___________________________________________________________________________
③若氧化产物比还原产物多1.75 mol,上述反应转移的电子数目为 。
(3)镁、铝合金3 g与100 mL稀H2SO4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4 g,则原硫酸溶液的物质的量浓度为
查看答案和解析>>
科目:高中化学 来源: 题型:
将淀粉水解,并用新制的氢氧化铜悬浊液检验其水解产物的实验中,要进行的主要操作是
①加热 ②滴入稀硫酸 ③加入新制的氢氧化铜悬浊液 ④加入足量的氢氧化钠溶液.
A.①→②→③→④→① B.②→①→④→③→①
C.②→④→①→③→① D.③→④→①→②→①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com