
【题目】(1)用A质子数,B中子数,C核外电子数,D最外层电子数,用序号回答下列问题。
①原子种类由______决定;
②元素种类由______决定;
③元素的化合价由______决定。
(2)2.0g由![]() 和
和![]() 构成的水
构成的水![]() ,该水分子的物质的量为______,含中子数为______。
,该水分子的物质的量为______,含中子数为______。
(3)核内中子数为N的![]() ,质量数为A,则该离子的核外电子数为______。
,质量数为A,则该离子的核外电子数为______。
【答案】AB A D 0.1mol ![]() 或
或![]()
![]()
【解析】
(1)①原子是具有一定数目质子和一定数目中子的一种原子,原子种类由质子数和中子数决定;
②元素是具有相同核内质子数![]() 或核电荷数
或核电荷数![]() 的一类原子的总称,由质子数决定;
的一类原子的总称,由质子数决定;
③化学性质主要由价电子决定,而主族元素价电子一般就是最外层电子,而副族元素大多还包括次外层的一些电子;
(2)根据![]() 计算可得;
计算可得;
(3)对应微粒![]() 来说,质量数
来说,质量数![]() 质子数
质子数![]() 中子数,核外电子数
中子数,核外电子数![]() 质子数
质子数![]() 所带电荷数。
所带电荷数。
(1)①原子是具有一定数目质子和一定数目中子的一种原子,原子种类由质子数和中子数决定,故答案为:AB;
②元素是具有相同核内质子数![]() 或核电荷数
或核电荷数![]() 的一类原子的总称,由质子数决定,故答案为:A;
的一类原子的总称,由质子数决定,故答案为:A;
③化学性质主要由价电子决定,而主族元素价电子一般就是最外层电子,而副族元素大多还包括次外层的一些电子,故答案为:D;
(2)![]() 的摩尔质量为
的摩尔质量为![]() ,
,![]() 的物质的量
的物质的量![]() ,分子含有中子数为
,分子含有中子数为![]() ,故含有的中子数目为
,故含有的中子数目为![]() 或
或![]() ,故答案为:
,故答案为:![]() ;
;![]() 或
或![]() ;
;
(3)对应微粒![]() 来说,质量数
来说,质量数![]() 质子数
质子数![]() 中子数,核外电子数
中子数,核外电子数![]() 质子数
质子数![]() 所带电荷数,所以该离子的核外电子数
所带电荷数,所以该离子的核外电子数![]() 质量数
质量数![]() 中子数
中子数![]() 所带电荷数
所带电荷数![]() ,故答案为:
,故答案为:![]() 。
。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. 氮原子的价电子排布图:![]()
B. 2p和3p轨道形状均为哑铃形,能量也相等
C. 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
D. 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图示信息判断,下列说法正确的是
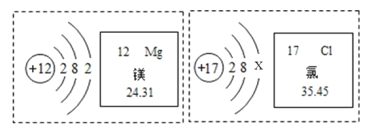
A.镁元素位于元素周期表第三周期,镁原子核内有 12个质子
B.氯的相对原子质量为 ![]() ,在化学变化值,氯原子易得电子
,在化学变化值,氯原子易得电子
C.当 ![]() 时,该微粒属于稀有气体的原子
时,该微粒属于稀有气体的原子
D.镁离子与氯离子的电子层数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H1
Fe2O3(s)+![]() CO(g)═
CO(g)═![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g)△H2
CO2(g)△H2
Fe3O4(s)+CO(g)═3Fe(s)+CO2(g)H3
Fe2O3(s)+CO(g)═2Fe(s)+3CO2(g)H4
则△H4的表达式为__________(用含△H1、△H2、△H3的代数式表示).
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下:
温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600℃时固体物质的主要成分为__________,该温度下若测得固体混合物中m(Fe):m(O)=35:2,则FeO被CO还原为Fe的百分率为__________(设其它固体杂质中不含Fe、O元素).
(3)铁等金属可用作CO与氢气反应的催化剂.已知某种催化剂可用来催化反应CO(g)+3H2(g)CH4(g)+H2O(g)△H<0.在T℃,106Pa时将lmolCO和3molH2加入体积可变的密闭容器中.实验测得CO的体积分数x(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
①能判断CO(g)+3H2(g)![]() CH4(g)+H2O(g)达到平衡的是__________(填序号).
CH4(g)+H2O(g)达到平衡的是__________(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(CO)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②达到平衡时CO的转化率为__________;在T℃106Pa时该反应的压强平衡常数Kp(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)的计算式为__________;
③图表示该反应CO的平衡转化率与温度、压强的关系.图中温度T1、T2、T3由高到低的顺序是__________,理由是__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体。A、B、C、D、E、F和OPA的转化关系如下所示:

已知:![]()
回答下列问题:
(1)A的化学名称是______;
(2)由A生成B的反应类型是_____。
(3)写出C可能的结构简式______;(写一个即可)
(4)D(邻苯二甲酸二乙酯)是一种增塑剂.请用A和不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D。用结构简式表示合成路线__________________________;
合成路线流程图示例如下:
(5)E→F的化学方程式为___________________________________。
(6)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,G可能的同分异构体有___种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铋片[主要成分(BiO)2CO3]可用于治疗慢性胃炎及缓解胃酸过多引起的胃病。由菱铋矿(主要成分为nBi2O3·mCO2·H2O,含杂质SiO2、CuS等)制备(BiO)2CO3的一种工艺如图:
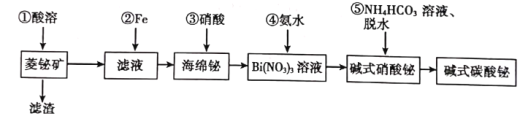
试回答下列问题:
(1)为提高①的“酸溶”速率,可以采取的措施是__________(任写一种)。
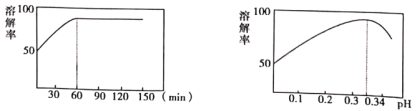
(2)①中酸溶解率与接触时间及溶液的pH之间的关系如图,据此分析,“酸溶”的最佳条件为__________;滤渣的主要成分是__________。
(3)“酸溶”后溶液必须保持强酸性,以防止铋元素流失,原理是__________。
(4)②中得到“海绵铋”的离子方程式为__________。
(5)④中反应的化学反应方程式为__________。
(6)25℃时,向浓度均为0.1mol·L-1的Fe2+、Cu2+、Bi3+的混合溶液中滴加Na2S溶液,当Fe2+恰好沉淀完全时,所得溶液c(Cu2+):c(Bi3+)=__________。(忽略Na2S溶液所带来的体积变化)。
资料:①有关溶度积数据见表:
难溶物质 | FeS | CuS | Bi2S3 |
Ksp(25℃) | 6.3×10-18 | 6.3×10-36 | 1.6×10-20 |
②溶液中的离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关实验现象.现在请你帮助该学生整理并完成实验报告.
(1)实验目的: ______
(2)实验用品:药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
仪器:① ______ ;② ______ ![]() 请填写两件主要的玻璃仪器
请填写两件主要的玻璃仪器![]()
(3)实验内容:
序号 | 实验方案 | 实验现象 |
① | 将少量氯水滴入盛有少量NaBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层 |
② | 将少量溴水滴入盛有少量KI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层 |
(4)实验结论: ______ .
(5)问题和讨论:请用结构理论简单说明得出上述结论的原因. ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com