
【题目】根据图示信息判断,下列说法正确的是
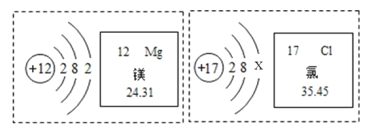
A.镁元素位于元素周期表第三周期,镁原子核内有 12个质子
B.氯的相对原子质量为 ![]() ,在化学变化值,氯原子易得电子
,在化学变化值,氯原子易得电子
C.当 ![]() 时,该微粒属于稀有气体的原子
时,该微粒属于稀有气体的原子
D.镁离子与氯离子的电子层数相等
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列结论中正确的是( )
A.25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
B.粗铜精炼时,当阳极质量减少6.4g时,电路中转移电子数一定不是0.2NA
C.含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
D.200mL0.5mol/LNa2CO3溶液中,由于CO32-水解,所以阴离子数目小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列粒子![]() 分子或离子
分子或离子![]() 均含有18个电子:
均含有18个电子:
粒子 | A+ | B2- | C | D | E | F |
组成特点 | 单核离 | 化合物, 双核分子 | 单质, 双核分子 | 化合物, 三核分子 | 化合物, 四核分子 | |
下列说法错误的是
A.A的元素符号是K,B2-的离子结构示意图是![]()
B.C的浓溶液可用于实验室制Cl2
C.D的单质具有强氧化性,可将其同族元素的单质从盐溶液中置换出来
D.F中可能既含极性键又含非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)画出下列元素的原子结构示意图。
①核电荷数为13的元素:__________。
②某元素原子的最外层电子数等于次外层电子数:__________________ 。
③L 层电子数是M层电子数2倍的元素: ___________________ 。
④某同位素原子核内没有中子的元素: ___________________ 。
(2)写出1~18号元素中符合下列条件的原子(离子)的微粒符号和结构示意图。
①某元素原子L层上的电子数为K层的3倍: __________________ 。
②某元素原子L层上的电子数为K层的一半: _________________ 。
③得到2个电子后,电子总数与氩原子的电子总数相同的离子: ___________________ 。
④某元素原子的最外层电子数等于次外层电子数的2倍: ___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吊白块(NaHSO2HCHO2H2O,次硫酸氢钠甲醛)是易溶于水的白色块状或结晶性粉状固体,在印染工业中被用作拔染剂和还原剂。可由Na2S2O5 (焦亚硫酸钠)、甲醛及锌粉反应制取,回答下列问题:
(1)已知在pH=4.1时的过饱和NaHSO3溶液将自动脱水生成Na2S2O5,制备原料Na2S2O5的装置如下。
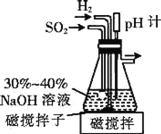
①通入H2的目的是______。
②吸滤瓶中先后发生的反应为_______、2NaHSO3=Na2S2O5↓+H2O。
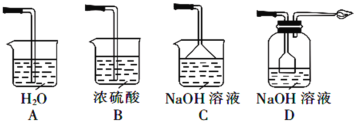
③从环境保护和安全考虑,下列尾气处理方法正确的是________(填标号)。
④实验室用稀NaOH溶液不能制得Na2S2O5,是因为_______。
(2)制备吊白块的装置(夹持及加热装置已略)如图:
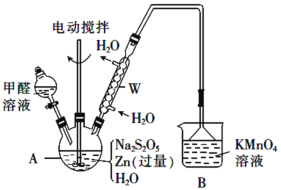
①仪器A的名称是_________。
②制备反应需在950C下进行,合适的加热方式是_____,A中发生反应的化学方程式为_____(Zn转化为等物质的量的ZnO和Zn(OH)2)。
③从A中的悬浊液中得到产品吊白块的实验操作是_________及干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用A质子数,B中子数,C核外电子数,D最外层电子数,用序号回答下列问题。
①原子种类由______决定;
②元素种类由______决定;
③元素的化合价由______决定。
(2)2.0g由![]() 和
和![]() 构成的水
构成的水![]() ,该水分子的物质的量为______,含中子数为______。
,该水分子的物质的量为______,含中子数为______。
(3)核内中子数为N的![]() ,质量数为A,则该离子的核外电子数为______。
,质量数为A,则该离子的核外电子数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L密闭容器中充入4molA气体和3molB气体,发生下列反应:2A(g)+B(g) ![]() C(g)+xD(g),5s达到平衡。达到平衡时,生成了1mol C,测定D的浓度为1mol/L。
C(g)+xD(g),5s达到平衡。达到平衡时,生成了1mol C,测定D的浓度为1mol/L。
(1)求x =____。
(2)求这段时间A的平均反应速率为_____。
(3)平衡时B的浓度为______。
(4)下列叙述能说明上述反应达到平衡状态的是_____
A 单位时间内每消耗2 mol A,同时生成1molC
B 单位时间内每生成1molB,同时生成1mol C
C D的体积分数不再变化
D 混合气体的压强不再变化
E B、C的浓度之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“![]() ”或“
”或“![]() ”回答下列问题
”回答下列问题
①元素的非金属性越强,其对应最高价氧化物水化物的酸性越______;
②元素的金属性越强,其对应最高价氧化物水化物的碱性越______;
③元素的______性越强,其对应气态氢化物的稳定性越______;
④酸性:![]() ______
______![]() ;气态氢化物稳定性:
;气态氢化物稳定性:![]() ______HCl。
______HCl。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com