
【题目】下列各组中两种微粒所含电子数不相等的是
A.H3O+和OHB.CO和N2
C.HNO2和![]() D.
D.![]() 和
和![]()
【答案】D
【解析】
粒子中质子数等于原子的质子数之和,中性微粒中质子数=电子数,阳离子的电子数=质子数-电荷数,阴离子的电子数=质子数+电荷数。
A项、H3O+的质子数为11,电子数为111=10,OH的质子数为9,电子数为9+1=10,电子数相等,故A正确;
B项、CO的质子数为14,电子数为14,N2的质子数为14,电子数为14,电子数相等,故B正确;
C项、HNO2的质子数为1+7+8×2=24,电子数为24,![]() 的质子数为7+8×2=23,电子数为23+1=24,电子数相等,故C正确;
的质子数为7+8×2=23,电子数为23+1=24,电子数相等,故C正确;
D项、![]()
![]() 的质子数为6+1×3=9,电子数为91=8,
的质子数为6+1×3=9,电子数为91=8,![]() 的质子数为11,电子数为111=10,电子数不相等,故D错误。
的质子数为11,电子数为111=10,电子数不相等,故D错误。
故选D。


科目:高中化学 来源: 题型:
【题目】假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是
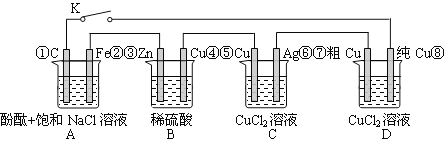
A.当K闭合时,A装置发生吸氧腐蚀,在电路中做电源
B.当K断开时,B装置锌片溶解,有氢气产生
C.当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→②
D.当K闭合后,A、B装置中pH变大,C、D装置中pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷在燃烧时放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知: 2C3H8(g)+7O2(g)=6CO(g)+8H2O(1) △H1 =-2741.8 kJmol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0 kJmol-1
(1)反应C3H8 (g)+5O2(g)=3CO2(g)+4H2O(l) △H=____________;
(2)现有1molC3H8在不足量的氧气里燃烧,生成1molCO和2molCO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)CO2(g)+H2(g) △H=+41.2kJmol-1
①下列事实能说明该反应达到平衡的是_____________;
a.体系中的压强不再变化 b.v正( H2) = v逆( CO ) c.混合气体的平均相对分子质量不再变化 d.CO2 的浓度不再发生变化
②5min 后体系达到平衡,经测定,容器中含 0.8 mol H2,则平衡常数K =______;
③其他条件不变,向平衡体系中充入少量CO,则平衡常数K______(填“增大”、“减小”或“不变”)
(3)根据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体 ;燃料电池内部是熔融的掺杂着氧化钆(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-,在电池内部O2-向______极移动(填“正”或“负”);电池的负极电极反应为________。
(4)用上述燃料电池和惰性电极电解足量Mg(NO3)2和NaCl的混合溶液,电解开始后阴极附近的现象为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe与Si形成的合金及铁的配合物用途非常广泛,回答下列问题:
(1)基态Fe2+核外价电子排布式为________;在基态Si原子中,核外存在_____对自旋方向相反的电子。
(2)Fe78Si9B13是一种非晶合金,可通过________方法区分晶体和非晶体。
(3)硅烯是一种具有石墨烯结构的新型二维材料,二硅烯Si2H4分子的几何构型为____,依据电子云的重叠方式可知其所含共价键类型是________。
(4)配合物[Fe(Htrz)3](ClO4) 2 (Htrz为![]() ,1,2,4-三氮唑)
,1,2,4-三氮唑)
①与Fe2+形成配位键的原子是_______;已知分子中的大![]() 键可用
键可用 ![]() 符号表示,其中m代表参与形成大
符号表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数,则配体
键的电子数,则配体![]() 中的大
中的大![]() 键应表示为_____
键应表示为_____
②1,2,4-三氮唑的沸点为260 ℃,环戊二烯(![]() )的沸点为42.5 ℃,前者的沸点比后者大得多,其原因是_____ 。
)的沸点为42.5 ℃,前者的沸点比后者大得多,其原因是_____ 。
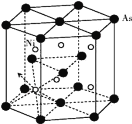
(5)砷化镍晶胞的结构如下图所示,1个砷化镍晶胞中含________个As;若六棱柱底边边长为a cm,高为c cm,阿伏加德罗数的值为NA,则砷化镍的密度为____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图示信息判断,下列说法正确的是
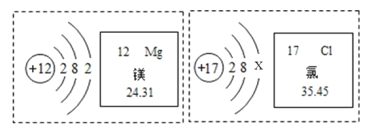
A.镁元素位于元素周期表第三周期,镁原子核内有 12个质子
B.氯的相对原子质量为 ![]() ,在化学变化值,氯原子易得电子
,在化学变化值,氯原子易得电子
C.当 ![]() 时,该微粒属于稀有气体的原子
时,该微粒属于稀有气体的原子
D.镁离子与氯离子的电子层数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体[CH3CH(OH)COO]2Fe·3H2O(M=288 g/mol)是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸CH3CH(OH)COOH与FeCO3反应制得.
I.制备碳酸亚铁
(1)利用如图所示装置进行实验。装置中仪器C的名称是____________。
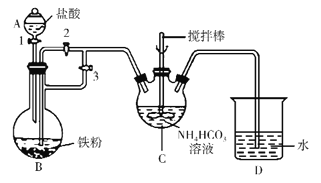
(2)实验开始时,首先关闭活塞2,打开活塞1、3,目的是________________________;关闭活塞1,反应一段时间后,关闭活塞_________,打开活塞___________,观察到B中溶液进入到C中,C中产生沉淀和气体。生成FeCO3的离子方程式为__________。
(3)装置D的作用是___________________。
Ⅱ.乳酸亚铁晶体的制备及纯度测定
将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸,从所得溶液中获得乳酸亚铁晶体。
(4)加入少量铁粉的作用是______________________________。
(5)用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其主要原因是____________________________________________。
(6)经查阅文献后,改用Ce(SO4)2标准溶液进行滴定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760 g样品,溶解后进行必要处理,用容量瓶配制成250 mL溶液,每次取25.00 mL,用0.1000 mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表所示:

则产品中乳酸亚铁晶体的纯度为________%(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体。A、B、C、D、E、F和OPA的转化关系如下所示:

已知:![]()
回答下列问题:
(1)A的化学名称是______;
(2)由A生成B的反应类型是_____。
(3)写出C可能的结构简式______;(写一个即可)
(4)D(邻苯二甲酸二乙酯)是一种增塑剂.请用A和不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D。用结构简式表示合成路线__________________________;
合成路线流程图示例如下: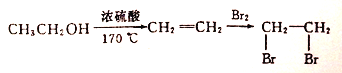
(5)E→F的化学方程式为___________________________________。
(6)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,G可能的同分异构体有___种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某空间站中宇航员的呼吸保障系统原理如图所示。
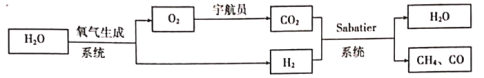
Sabatier系统中发生反应为:
反应I:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H1
CH4(g)+2H2O(g)△H1
反应II:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2=+41.2kJ/mol
CO(g)+H2O(g)△H2=+41.2kJ/mol
(1)常温常压下,已知:
①H2和CH4的燃烧热(△H)分别为-285.5kJ·mol-1和-890.0kJ·mol-1;
②H2O(l)=H2O(g)△H3=+44.0kJ·mol-1。则△H1=__________kJ·mol-1。
(2)按![]() =4的混合气体充入Sabatier系统,当气体总压强为0.1MPa,平衡时各物质的物质的量分数如图所示;不同压强时,CO2的平衡转化率如图所示:
=4的混合气体充入Sabatier系统,当气体总压强为0.1MPa,平衡时各物质的物质的量分数如图所示;不同压强时,CO2的平衡转化率如图所示:
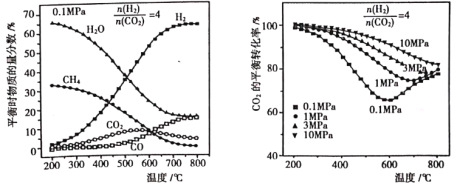
①Sabatier系统中应选择适宜的温度是__________。
②200~550℃时,CO2的物质的量分数随温度升高而增大的原因是__________。
③当温度一定时,随压强升高,CO2的平衡转化率增大,其原因是__________。
(3)一种新的循环利用方案是用Bosch反应[CO2(g)+2H2(g)![]() C(s)+2H2O(g)]代替Sabatier系统。
C(s)+2H2O(g)]代替Sabatier系统。
①分析Bosch反应的熵值变化为:△S__________0(选填“>”或“<”)。
②温度一定时,在2L密闭容器中按![]() =2投料进行Bosch反应,达到平衡时体系的压强为原来压强p0的0.7倍,该温度下反应平衡常数Kp为__________(用含p0的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
=2投料进行Bosch反应,达到平衡时体系的压强为原来压强p0的0.7倍,该温度下反应平衡常数Kp为__________(用含p0的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③下列措施能提高Bosch反应中CO2转化率的是_________(填标号)。
A.加快反应器中气体的流速B.提高原料气中CO2所占比例
C.增大催化剂的表面积D.反应器前段加热,后段冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是( )
选项 | 实验操作 | 现象 |
A | AgNO3溶液滴入氯水中 | 产生白色沉淀,随后淡黄绿色逐渐褪去 |
B | FeCl3溶液滴入Mg(OH)2浊液中 | 白色浑浊转化为红褐色沉淀 |
C | H2C2O4溶液滴入KMnO4酸性溶液中 | 产生气泡,随后紫色褪去 |
D | Na块放在坩埚里并加热 | 发出黄色火焰,生成淡黄色固体 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com