
| A、还原剂 |
| B、氧化剂 |
| C、既是氧化剂又是还原剂 |
| D、既不是氧化剂又不是还原剂 |
 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
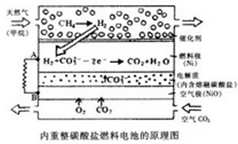 以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图,下列说法正确的是( )
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图,下列说法正确的是( )| A、该电池将热能转化为电能 |
| B、外电子流动方向:由B流向A |
| C、空气极发生电极反应式为:O2+4c-+2CO2=2CO32- |
| D、以此电池为电源电解精炼铜,当有0.1mole-转移时,有3.2g铜溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L1.0mol?L-1的NaAlO2的水溶液中含氧原子个数为2NA |
| B、12g石墨烯(单层石墨)中含有六元环个数为0.5NA |
| C、25℃时pH=13的NaOH溶液中含有的0H-数目为0.1NA |
| D、0.1mol基和0.1mol氢氧根离子所含电子数均为0.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 电子数 | 10 | 14 | 16 | 18 |
| A、四种气体中至少有两种气体互为同分异构体 |
| B、四种气体通入Br2的CCl4溶液中,都能使其褪色 |
| C、气体丙分子中的所有原子在同一平面 |
| D、鉴别乙和丙两种气体,可以用酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题.
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1.由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 性质 |
| X | 其单质在潮湿的空气中放置表面易产生绿色的锈迹 |
| Y | 该元素在地壳中的含量仅次于氧 |
| Z | Z的氢化物能使湿润的红色石蕊试纸变蓝 |
| W | 单质为黄绿色气体,有毒 |
| T | T的一种核素质量数为32,其质子数与中子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
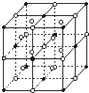 A、B、C、D是短周期元素,它们的离子具有相同的电子层结构,且半径依次减小.A与D的化合物X既能与盐酸反应,又能与NaOH溶液反应;B、C组成典型的离子化合物Y,其晶体结构类似于NaCl晶体;A与C以原子个数之比1:1组成化合物Z.
A、B、C、D是短周期元素,它们的离子具有相同的电子层结构,且半径依次减小.A与D的化合物X既能与盐酸反应,又能与NaOH溶液反应;B、C组成典型的离子化合物Y,其晶体结构类似于NaCl晶体;A与C以原子个数之比1:1组成化合物Z.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com