
【题目】下列说法或表示方法中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=-2×57.3kJ·mol-1
B.101kPa时,H2的热值为142.75kJ·g-1,则表示氢气标准燃烧热的热化学方程式为:H2(g)+![]() O2(g)=H2O(l) ΔH=-142.75kJ·mol-1
O2(g)=H2O(l) ΔH=-142.75kJ·mol-1
C.由C(金刚石)=C(石墨) ΔH=-1.9kJ·mol-1可知,金刚石比石墨稳定
D.同温同压下,4Al(s)+3O2(g)=2Al2O3(s)在常温和点燃条件下的ΔH相同
【答案】D
【解析】
A. 中和热是指强酸与强碱反应,生成1molH2O时所放出的热量,如果不考虑SO42-+Ca2+=CaSO4↓所放出的热量,H2SO4和Ca(OH)2反应的中和热ΔH=-57.3kJ·mol-1,A错误;
B. 101kPa时,H2的热值为142.75kJ·g-1,则表示氢气标准燃烧热的热化学方程式为:H2(g)+![]() O2(g)=H2O(l) ΔH=-2×142.75kJ·mol-1,B错误;
O2(g)=H2O(l) ΔH=-2×142.75kJ·mol-1,B错误;
C. 由C(金刚石)=C(石墨) ΔH=-1.9kJ·mol-1可知,金刚石的能量比石墨高,石墨更稳定,C错误;
D. 同温同压下,一个反应的ΔH不受反应条件的影响,所以4Al(s)+3O2(g)=2Al2O3(s)在常温和点燃条件下的ΔH相同,D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如图所示,实验操作为:预先使棉花团浸透乙醇,并按照图装置好,在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。
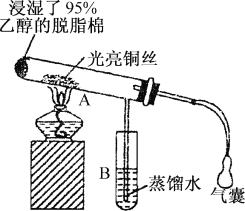
请回答以下问题:
(1)被加热的铜丝处发生反应的化学方程式为:________。
(2)从A管中可观察到_______的实验现象,从中可认识到在该实验过程中,催化剂起催化作用时参加了化学反应,还可认识到催化剂起催化作用时需要一定的_______。
(3)已知醇的氧化反应是放热反应,在实验进行一段时间后,如果只撤掉酒精灯,反应还能否继续进行?______;原受热的铜丝处有什么现象?_______。
(4)验证乙醇氧化产物的化学方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )
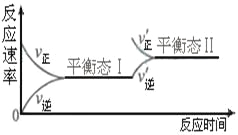
A. 反应达平衡时,正反应速率和逆反应速率相等
B. 该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C. 该反应达到平衡态后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D. 同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香天竺葵醇具有温和、香甜的玫瑰花气息,其结构式如图所示。下列有关香天竺葵醇的说法错误的是
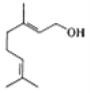
A.分子中含有两种官能团
B.该物质中的碳原子一定全部共面
C.使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理不同
D.香天竺葵醇能发生加聚反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_______(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_______(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=________mol,NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2________α1(填“>”“<”或“=”),平衡常数K2______(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(NO![]() )、c(NO
)、c(NO![]() )和c(CH3COO-)由大到小的顺序为______________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)可使溶液A和溶液B的pH相等的方法是________。
)和c(CH3COO-)由大到小的顺序为______________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容绝热密闭容器中发生CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g),下列情况都能说明该反应已达到平衡状态的是( )
2N2(g)+CO2(g)+2H2O(g),下列情况都能说明该反应已达到平衡状态的是( )
①容器内混合气体的平均相对分子质量不再变化;②容器内气体密度不再发生变化;
③容器内气体的压强不再发生变化; ④v正(NO):v逆(N2):v逆(CO2)=4:2:1;
A.①②③B.③④C.①②③④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)![]() 4C(g)+D(g) ΔH<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入B的物质的量的变化关系如右图所示。下列说法正确的是( )
4C(g)+D(g) ΔH<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入B的物质的量的变化关系如右图所示。下列说法正确的是( )

A. 若保持压强一定,当温度升高后,则图中θ>45
B. 若再加入B,则再次达到平衡时正、逆反应速率均逐渐增大
C. 若保持压强一定,再加入B,则反应体系气体密度减小
D. 平衡时B的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3可用作有机合成的催化剂,食品膨松剂等。已知AlCl3、FeCl3分别在183℃、315℃时升华,无水AlCl3遇潮湿空气即产生大量白雾。
I.工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水AlCl3的流程如下:
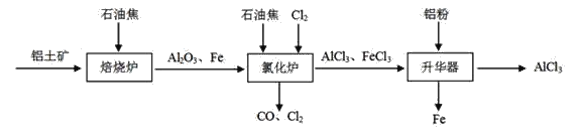
(1)焙烧炉中发生反应:①Fe2O3(s)+3C(s)![]() 2Fe(s) +3CO(g);
2Fe(s) +3CO(g);
②3CO(g)+Fe2O3(s)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
则反应②的平衡常数的表达式为K=_____。
(2)氯化炉中Al2O3、Cl2和C在高温下发生反应的化学方程式为_____;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为____。
(3)精制无水AlCl3的合格品中,AlCl3的质量分数不得低于96%。现称取16.25g精制后的无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.16g。该样品中AlCl3的质量分数为_____。
II.实验室可用下列装置制备无水AlCl3。装置B、C中应盛放的试剂名称分别为_____、_____,F中所盛放试剂的作用是_____。
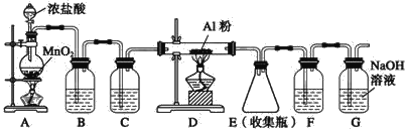
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 已 知 16 g 固 体 硫 完 全 燃 烧 时 放 出 148.4 kJ的 热 量 , 该 反 应 的 热 化 学 方 程 式 是________________。
(2)2mol乙醇 燃烧 时,生成液 态水 和二 氧化碳 ,同 时放 出 2733.6kJ 的热 量, 写出 该反应 的热 化学 方程式________________________________。
(3)用 NA 表示阿伏加德罗常数,在 C2H2(气态)完全燃烧生成 CO2 和液态水的反应中,每有 5NA 个电子转移时,放出650 kJ 的热量。其燃烧热的热化学方程式为_____。
(4).在一定条件下,通入 80 g SO2 气体充分生成 SO3 气体时,放 出热量 98.3 kJ,已知 SO2 在此条件下转化率为 80%,则该反应的热化学方程________________________________。
(5)已知:CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ/mol;CO2 (g) +3H2(g)=CH3OH(g)+ H2O(g) △H3=c kJ/mol;2CH3OH(g)= CH3OCH3(g) + H2O(g) △H4=d kJ/mol
求:2CO(g) + 4H2 (g)=CH3OCH3(g) + H2O(g) △H=_____kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com