
【题目】在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)![]() 4C(g)+D(g) ΔH<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入B的物质的量的变化关系如右图所示。下列说法正确的是( )
4C(g)+D(g) ΔH<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入B的物质的量的变化关系如右图所示。下列说法正确的是( )

A. 若保持压强一定,当温度升高后,则图中θ>45
B. 若再加入B,则再次达到平衡时正、逆反应速率均逐渐增大
C. 若保持压强一定,再加入B,则反应体系气体密度减小
D. 平衡时B的转化率为50%
【答案】D
【解析】
从图中可以看出,角度为45°,增加C的量等于增加B的量,即通入4molC,逆向反应,生成2molB,同时剩下2molC,反向同样成立(体积可变,恒压,等效平衡),故B的转化率为50%;升高温度平衡逆向移动,C的量减少,B的量增加,角度小于45°;压强一定加入B,形成恒压等效平衡,再次达到平衡时正、逆反应速率均不变;压强一定加入B,形成恒压等效平衡,平衡不移动,密度不变。
A项、压强一定,当升高温度时,平衡逆向移动,则C的物质的量减少,由图可以看出,图中θ<45°,A错误;
B项、压强一定加入B,形成恒压等效平衡,再次达到平衡时正、逆反应速率均不变,B错误;
C项、由于A为固体,压强一定再加入B,形成恒压等效平衡,平衡不移动,所以若再加入B,则再次达到平衡时反应体系气体密度始终不变,C错误;
D项、根据图象结合方程式可知,加入的B物质的物质的量与生成C物质的物质的量相等,所以该反应中有一半的B物质反应,所以其转化率为50%,D正确。
故选D。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】在一恒温恒压的密闭容器中发生如下反应:A(g)+B(g)2C(g) △H<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示。下列说法不正确的是( )
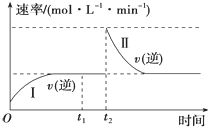
A.0~t2时,v(正)>v(逆)
B.Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ=Ⅱ
C.t2时刻改变的条件是向密闭容器中加C
D.Ⅰ、Ⅱ两过程达到平衡时,平衡常数K(Ⅰ)=K(Ⅱ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知重铬酸钾(K2Cr2O7)具有强氧化性,其还原产物Cr3+在水溶液中呈绿色或蓝绿色。在K2Cr2O7溶液中存在下列平衡:Cr2O72(橙色) + H2O![]() 2CrO42(黄色) + 2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )
2CrO42(黄色) + 2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )

A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=-2×57.3kJ·mol-1
B.101kPa时,H2的热值为142.75kJ·g-1,则表示氢气标准燃烧热的热化学方程式为:H2(g)+![]() O2(g)=H2O(l) ΔH=-142.75kJ·mol-1
O2(g)=H2O(l) ΔH=-142.75kJ·mol-1
C.由C(金刚石)=C(石墨) ΔH=-1.9kJ·mol-1可知,金刚石比石墨稳定
D.同温同压下,4Al(s)+3O2(g)=2Al2O3(s)在常温和点燃条件下的ΔH相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )
A.3 mol·L-1B.2 mol·L-1C.4 mol·L-1D.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某传感器工作原理如图所示。利用该传感器可以测定空气中NO、CO、NH3、SO2等有害气体的含量。下列说法正确的是

A. 传感器工作中,电子由Pt(Ⅰ)极经电流仪传到Pt(Ⅱ)极
B. 若M为熔融KOH,X为NH3,Y为N2,则负极的电极反应式为2NH3-6e- = N2+6H+
C. 若M是含O2-的固体电解质,X为NO,则正极的电极反应式为O2 + 4e- = 2O2-
D. 若X为CO,M为KOH溶液,则电池总反应为2CO+O2 = 2CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:2X(g)+Y(s)![]() Z(g)+W(g),若其化学平衡常数K和温度t的关系如下表
Z(g)+W(g),若其化学平衡常数K和温度t的关系如下表

下列叙述不正确的是( )
A.上述反应的正反应是吸热反应
B.该反应的化学平衡常数表达式为K=![]()
C.若在1L的密闭容器中通入X和Y各1mol,5min后温度升高到800℃,此时测得X为0.33mol,该反应达到平衡状态
D.混合气体的密度保持不变可作为该反应达到平衡的标志之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述不正确的是
A.冰醋酸中逐滴加水,则溶液的导电性和醋酸的电离程度均先增大后减小
B.若根据反应“![]() ”设计成燃料电池,既可发电同时还可用于制备盐酸
”设计成燃料电池,既可发电同时还可用于制备盐酸
C.可逆反应的正、逆反应平衡常数数值互为倒数
D.电镀铜时,纯铜做阳极,电镀液为![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用自然界存在的角膜硼镁矿![]() 主要成分为
主要成分为![]() 制取金属镁和粗硼,工艺过程如下:
制取金属镁和粗硼,工艺过程如下:

根据以上信息回答下列问题:
(1)硼砂中硼的化合价 ______ ,溶于热水后,若需要调节pH为![]() 制取硼酸,写出该反应的离子方程式: ______ 。
制取硼酸,写出该反应的离子方程式: ______ 。
(2)从氯化镁晶体制得无水氯化镁的条件是 ______ ;其理由是 ______ ,若用惰性电磁电解![]() 溶液,写出电解过程的离子方程式: ______ 。
溶液,写出电解过程的离子方程式: ______ 。
(3)制得的粗硼可在一定条件与![]() 作用生产
作用生产![]() ,再提纯
,再提纯![]() ,
,![]() 沸点较低,提纯可采用 ______ ;高温时
沸点较低,提纯可采用 ______ ;高温时![]() 即可分解,得到高纯度硼。根据分解生成碘的量还可以测定粗硼的粗度。方法如下:
即可分解,得到高纯度硼。根据分解生成碘的量还可以测定粗硼的粗度。方法如下:
称取![]() 粗硼转化成纯
粗硼转化成纯![]() ,再完全分解,生成的碘用
,再完全分解,生成的碘用![]() 的
的![]() 溶液滴定至终点,消耗标准液
溶液滴定至终点,消耗标准液![]() 滴定原理:
滴定原理:![]()
①滴定终点判断应用 ______ 作指示剂;
②标准液应盛装在 ______ 滴定管中;
③该粗硼的纯度为 ______ 。
(4)![]() 酸性染料电池的反应机理为:
酸性染料电池的反应机理为:![]() ,则电池正极反应式为 ______ ;常温下,若起始电解液
,则电池正极反应式为 ______ ;常温下,若起始电解液![]() ,则电池工作一段时间后,电解液
,则电池工作一段时间后,电解液![]() ,此时溶液中
,此时溶液中![]() ______ ;当溶液
______ ;当溶液![]() 时,镁元素的主要存在形式是 ______ 。
时,镁元素的主要存在形式是 ______ 。![]() 已知:
已知:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com