
| A. | 450mL | B. | 500mL | C. | 400mL | D. | 不能确定 |
分析 当镁、铝元素恰好完全沉淀下来时,此时溶质为NaCl,根据n=cV计算出HCl的物质的量,然后根据钠元素、氯元素守恒列式计算出需要NaOH的物质的量,然后根据V=$\frac{n}{c}$计算出需要1mol•L-1NaOH溶液的体积.
解答 解:一定量MgO和Al2O3的混合物投入250mL 2mol•L-1的盐酸中,充分反应后无固体剩余,反应后生成氯化镁、氯化铝,盐酸可能有剩余;再向反应后的溶液中加入1mol•L-1NaOH溶液,要使镁、铝元素恰好完全沉淀下来,此时溶质为NaCl,根据钠元素、氯元素守恒可知:n(NaCl)=n(NaOH)=n(HCl)=2mol/L×0.25L=0.5mol,
则需要加入1mol•L-1NaOH溶液的体积为:$\frac{0.5mol}{1mol/L}$=500mL,
故选B.
点评 本题考查了混合物反应的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(s) | 0 | 4 | 8 | 12 | 16 | 20 |
| n(N2O4)(mol) | 0.40 | a | 0.20 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加入AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加入足量NaOH溶液并加热 | 收集到气体0.896L(换算成标准状况) |
| 3 | 加入足量BaCl2溶液,将所得沉淀洗涤、干燥、称重;再向沉淀中加足量的稀盐酸,洗涤、干燥、称重 | 第一次称重读数为6.27g,第二次称重读数为2.33g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(SO2)=4mol•L-1•min-1 | B. | v(O2)=3mol•L-1•min-1 | ||
| C. | v(SO2)=0.1mol•L-1•s-1 | D. | v(O2)=0.1mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质类别 | 烯烃 | 酚 | 醛 | 硝基化合物 |
| 官能团名称 | 碳碳双键 | 羟基 | 醛基 | 硝基 |
| 结构简式 |  | -OH | -CHO | -NO2 |
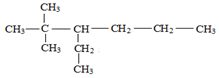 的名称为2,2-二甲基-3-乙基己烷.
的名称为2,2-二甲基-3-乙基己烷.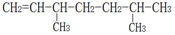 的名称为2,5-二甲基-1-庚烯.
的名称为2,5-二甲基-1-庚烯.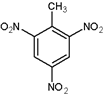 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com