
【题目】以二氧化碳为原料制备尿素工艺被广泛研究。其反应机理为:
反应Ⅰ:CO2(g)+2NH3(g)NH2COONH4(l) H1=-117.2 kJ·mol1
反应Ⅱ:NH2COONH4(l)NH2CONH2(l)+H2O(l) H2= +15.0 kJ·mol1
(1)反应Ⅰ平衡常数K的表达式为_____________。
(2)由CO2(g)和NH3(g)合成尿素NH2CONH2(l)的热化学方程式是__________。
(3)在恒容容器中按物质的量之比1∶2通入CO2和NH3,下列不能说明合成尿素反应达平衡状态的是_________。
A.容器中气体平均相对分子质量不再变化
B.容器中气体密度不再变化
C.NH3的体积分数不再变化
D.容器内压强不再变化
(4)通过实验发现,其他条件不变时,改变NH3、CO2的物质的量之比可增加尿素的产率,如图为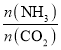 与尿素产率的关系曲线。通过曲线可知:______________过量对尿素产率的影响比较小。若在固定容器中按
与尿素产率的关系曲线。通过曲线可知:______________过量对尿素产率的影响比较小。若在固定容器中按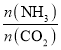 等于3.0通入CO2和NH3,则合成尿素反应达平衡后,混合气体中CO2的物质的量分数为________(精确到0.1%)。
等于3.0通入CO2和NH3,则合成尿素反应达平衡后,混合气体中CO2的物质的量分数为________(精确到0.1%)。
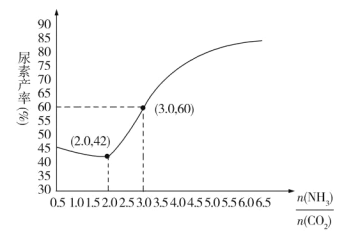
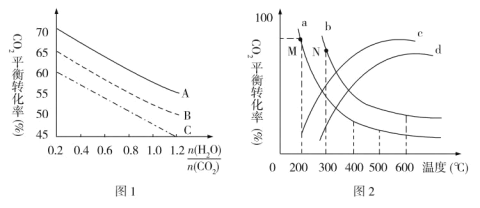
(5)探究发现,温度、压强、n(H2O)条件对合成尿素反应的影响如图1、图2,根据图像回答下列问题:
①其他条件不变时,对于合成尿素的反应,若通入CO2物质的量一定,按三种投料比[分别为 3.0、3.5、4.0]投料时,得到如图1的横轴对CO2的平衡转化率的影响曲线。曲线A对应的投料比是________。
②图2中a、b、c、d 四条曲线中的两条代表压强分别为20 MPa、25 MPa时CO2平衡转化率曲线,其中表示20MPa的是_________(填字母)。在实际生产中采用图2中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的主要原因是________。
【答案】K=![]() CO2(g)+2NH3(g)NH2CONH2(l)+H2O(l) ΔH=-102.2 kJ·mol1 AC CO2 18.2% 4.0 a 与300 ℃相比,200 ℃时CO2的平衡转化率更高;虽然压强越大、温度越高反应速率越快,但200 ℃、20 MPa条件下,对设备要求低,有利于降低成本
CO2(g)+2NH3(g)NH2CONH2(l)+H2O(l) ΔH=-102.2 kJ·mol1 AC CO2 18.2% 4.0 a 与300 ℃相比,200 ℃时CO2的平衡转化率更高;虽然压强越大、温度越高反应速率越快,但200 ℃、20 MPa条件下,对设备要求低,有利于降低成本
【解析】
(1)反应中有固体或纯液体参加,则它们的浓度不应写在平衡常数的表达式中,NH2COONH4(l)是纯液体,则反应Ⅰ的平衡常数表达式为K=![]() ;答案为:K=
;答案为:K=![]() ;
;
(2)根据盖斯定律,反应Ⅰ+反应Ⅱ得:CO2(g)+2NH3(g)![]() NH2CONH2(l) +H2O(l) ΔH= H1+H2=-117.2 kJ·mol1+(+15.0 kJ·mol1)=-102.2 kJ·mol1。答案为:CO2(g)+2NH3(g)
NH2CONH2(l) +H2O(l) ΔH= H1+H2=-117.2 kJ·mol1+(+15.0 kJ·mol1)=-102.2 kJ·mol1。答案为:CO2(g)+2NH3(g)![]() NH2CONH2(l) +H2O(l) ΔH=-102.2 kJ·mol1;
NH2CONH2(l) +H2O(l) ΔH=-102.2 kJ·mol1;
(3)A.由于该混合气体反应前后均是CO2和NH3,且体积分数之比恒为1∶2,故容器中气体平均相对分子质量恒定不变,不能说明反应达到平衡;A项错误;
B.容器中气体密度等于气体质量除以容器体积,由于气体总质量在减少,故气体密度不再变化时,反应达到平衡;B项正确;
C.整个反应过程NH3的体积分数恒定为![]() ,故不能说明达到平衡;C项错误;
,故不能说明达到平衡;C项错误;
D.压强与气体总物质的量相关,由于气体总物质的量在变化,故容器内压强不变时,说明反应达到平衡。D项正确;
答案为A、C。
(4)根据曲线可知,CO2过量,尿素产率由42%增加至45%,而NH3过量,尿素产率由42%增加至接近90%,故CO2过量对尿素产率的影响比较小。根据图像知,![]() =3时,尿素产率为60%,可转化为CO2转化率为60%,再利用三段式求解。
=3时,尿素产率为60%,可转化为CO2转化率为60%,再利用三段式求解。
设反应中CO2投入了amol,NH3投入了3amol,则有:
CO2 (g) + 2NH3(g)NH2CONH2(l) + H2O(l)

则混合气体中CO2的物质的量分数为![]() ,答案为:18.2%;
,答案为:18.2%;
(5)①当![]() 一定时,
一定时,![]() 比值越大,即NH3越多,CO2span>转化率越大,故A曲线代表比值为4.0。答案为:4.0;
比值越大,即NH3越多,CO2span>转化率越大,故A曲线代表比值为4.0。答案为:4.0;
②由于合成尿素反应CO2(g)+2NH3(g)NH2CONH2(l)+H2O(l) ΔH=-102.2 kJ·mol1是一个放热反应,因此温度升高,平衡逆向移动,CO2的平衡转化率降低,从曲线a,b中选择。当温度一定,压强增大,平衡正向移动,CO2的平衡转化率增大,故20 MPa条件下的曲线为a。M点条件为200 ℃,20MPa;N点条件为300 ℃,25 MPa。与300℃相比,200℃时CO2的平衡转化率更高;虽然压强越大、温度越高反应速率越快,但200℃、20MPa条件下,对设备要求低,有利于降低成本。答案为:a;与300℃相比,200℃时CO2的平衡转化率更高;虽然压强越大、温度越高反应速率越快,但200℃、20MPa条件下,对设备要求低,有利于降低成本。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】锰酸锂(LiMn2O4)是最早制得的具有三维锂离子通道的正极材料。以MnSO4和LiFePO4为原料制备锰酸锂的流程如图:
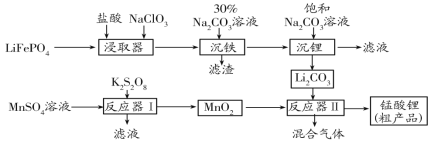
请回答下列问题:
(1)“沉铁”过程所得滤渣为白色固体,其主要成分是___。
(2)K2S2O8中S的化合价为+6价,则S2O82-中含过氧键的数目为__,反应器Ⅰ中发生反应的离子方程式__。
(3)反应器Ⅱ中反应温度为600~750℃。升温到515℃时,开始有CO2产生,比碳酸锂的分解温度(723℃)低得多,可能的原因是___。
(4)制得的锰酸锂粗产品中混有LiMnO2,写出在高温条件下反应产生LiMnO2的化学方程式___;称取一定量的锰酸锂粗产品于锥形瓶中,加入稀硫酸充分溶解,滴入含0.14molNa2C2O4的标准溶液时恰好完全反应,同时生成0.19molMn2+,则锰酸锂粗产品中LiMn2O4物质的量分数为___。 (MnO2-、Mn2O4-被还为Mn2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列说法符合“绿色化学”的是()
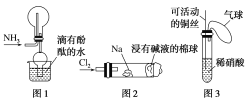
①实验室收集氨气采用图1所示装置
②实验室中做氯气与钠反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A.②③④B.①②③C.①③④D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列数量的各物质所含原子个数由大到小顺序排列的是( )
①0.5mol氨气 ②4g氦气 ③4℃时9mL水 ④0.2mol磷酸钠
A. ④③②①B. ①④③②C. ②③④①D. ①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素R、X、Y、Z。若它们的最外层电子数用n表示,则有:n(X)+n(Y)=n(Z),n(X)+n(Z)=n(R)。这四种元素组成一种化合物Q,Q具有下列性质:
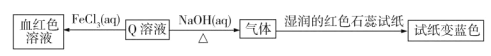
下列说法错误的是
A.原子半径:Y>Z>XB.最高价氧化物对应水化物酸性:Y<Z
C.X和Y组成的化合物在常温下都呈气态D.Y3Z4是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
(1)锌和镉位于同副族,而锌与铜相邻。现有 4 种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是______(填字母)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是_______。在硫的化合物中,H2S、CS2都是三原子分子,但它们的键角(立体构型)差别很大,用价层电子对互斥理论解释:_________;用杂化轨道理论解释:_________。
(3)Cd2+与NH3等配体形成配离子。[Cd(NH3)4]2+中2个NH3被2个Cl-替代只得到1种结构,它的立体构型是___________。1 mol [Cd(NH3)4]2+含___________mol σ键。
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为__________。
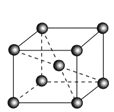
(5)锆晶胞如图所示,1个晶胞含_______个Zr原子;这种堆积方式称为__________。
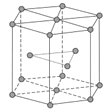
(6)镉晶胞如图所示。已知:NA是阿伏加德罗常数的值,晶体密度为 d g·cm-3。在该晶胞中两个镉原子最近核间距为______nm(用含NA、d的代数式表示),镉晶胞中原子空间利用率为________(用含π的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①正丁醇沸点:117. 2℃,正丁醛沸点:75. 7℃;②CH3CH2CH2CH2OH![]() CH3CH2CH2CHO。利用如图装置用正丁醇合成正丁醛,下列说法不正确的是
CH3CH2CH2CHO。利用如图装置用正丁醇合成正丁醛,下列说法不正确的是

A.为防止产物进一步氧化,应将适量Na2Cr2O7酸性溶液逐滴加入正丁醇中
B.当温度计1示数为90~95℃,温度计2示数在76℃左右时收集产物
C.向分馏出的馏出物中加入少量金属钠,可检验其中是否含有正丁醇
D.向分离所得的粗正丁醛中,加入CaCl2固体,过滤,蒸馏,可提纯正丁醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】昆明得天独厚的气候地理条件,造就了亚洲第一鲜花交易市场。生活中人们为了延长鲜花的寿命,通常会加入鲜花保鲜剂。
下表是0.25 L某种鲜花保鲜剂中含有的成分及含量(部分成分省略)。回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖(C12H22O11) | 12.50 | 342 |
硫酸钾(K2SO4) | 0.125 | 174 |
高锰酸钾(KMnO4) | 0.125 | 158 |
硝酸银(AgNO3) | 0.01 | 170 |
…… | …… | …… |
(1)鲜花保鲜剂的下列成分中,不属于电解质的是__________(填标号)。
a.C12H22O11 b.K2SO4 c.KMnO4 d.AgNO3
(2)欲配制250 mL该鲜花保鲜剂,现已提供下列仪器:①250mL容量瓶②量筒③烧杯④药匙⑤电子天平,如要完成实验,缺少的玻璃仪器还有_________、_________ (写仪器名称)。
(3)下列操作会使所配鲜花保鲜剂浓度偏低的是__________(填标号)。
a.容量瓶用蒸馏水洗净后没有烘干 b.用玻璃棒引流,将溶液转移到容量瓶中时有溶液洒到了容量瓶外面 c.定容时俯视刻度线 d.滴加蒸馏水,使溶液凹面刚好与刻度线相切,盖上瓶塞反复摇匀后,静置,发现液面比刻度线低,再加水至刻度线
(4)写出该鲜花保鲜剂中K+的物质的量浓度的计算式(省略成分中不含K+)_______(不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六氟化硫分子为正八面体构型(分子结构如图),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途。下列推测正确的是( )
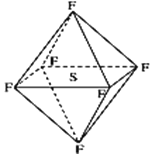
A. SF6分子是含有极性键的非极性分子
B. SF6各原子均达8电子稳定结构
C. SF6易燃烧生成SO2
D. SF6是原子晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com