
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
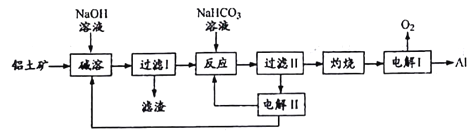
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为____________。
(2)向“过滤I”所得滤液中加入NaHCO3溶液,溶液的PH_____(填“增大”、“不变”或“减小”),NaHCO3中存在化学键有______
(3)“电解I”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是________。
(4)“电解II”是电解Na2CO3溶液,原理如图所示。

阳极的电极反应式为_______,阴极产生的物质A的化学式为_______。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是________________。
【答案】 Al2O3+2OH-==2AlO2-+H2O 减小 离子键和共价键 石墨电极被阳极上产生的O2氧化 4CO32-+2H2O-4e-=4HCO3- H2 NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜
【解析】以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝,由流程可知,加NaOH溶解时Fe2O3不反应,由信息可知SiO2在“碱溶”时转化为铝硅酸钠沉淀,过滤得到的滤渣为Fe2O3、铝硅酸钠,碳酸氢钠与偏铝酸钠反应生成Al(OH)3,过滤II得到Al(OH)3,灼烧生成氧化铝,电解I为电解氧化铝生成Al和氧气,电解II为电解Na2CO3溶液,结合图可知,阳极上碳酸根离子失去电子生成碳酸氢根离子和氧气,阴极上氢离子得到电子生成氢气。
(1)“碱溶”时生成偏铝酸钠的离子方程式为:Al2O3+2OH-==2AlO2-+H2O;(2)向“过滤I”所得滤液中加入NaHCO3溶液,与NaAlO2反应生成氢氧化铝沉淀和碳酸钠,碱性为OH->AlO2->CO32-,可知溶液的pH减小,NaHCO3中存在化学键有:离子键和共价键;(3)“电解I”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是石墨电极被阳极上产生的O2氧化。(4)由图可知,阳极反应为4CO32-+2H2O-4e-═4HCO3-+O2↑,阴极上氢离子得到电子生成氢气,则阴极产生的物质A的化学式为H2。(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,甲、乙两池中均为1 mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始时先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流表指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是( )

A. 闭合K1,断开K2后,A电极增重
B. 闭合K1,断开K2后,乙池溶液浓度上升
C. 断开K1,闭合K2后,A电极发生氧化反应
D. 断开K1,闭合K2后,NO![]() 向B电极移动
向B电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大。第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的最高价含氧酸根离子中其中心原子采取 杂化。
(3)与A、B形成的阴离子(AB-)互为等电子体的分子有 。
(4)基态D原子的核外电子排布式为 ,下图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比为 。

(5)向D的高价态硫酸盐溶液中逐滴滴加B的氢化物水溶液至过量,先出现沉淀,最后沉淀溶解形成溶液。写出此沉淀溶解的离子方程式:_ ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚A是食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大。下列有关双酚A的叙述不正确的是
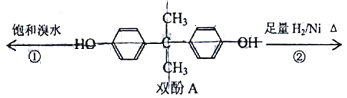
A. 双酚A的分子式是C15H6O2
B. 反应①中,1mol双酚A 最多消耗2molBr2
C. 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3
D. 反应②的产物中只有一种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得溶液中加入CuO,Cu(OH)2,Cu2(OH)2CO3各0.1mol的混合物后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶液)。则电解过程中转移电子的物质的量为( )
A. 0.6mol B. 0.8mol C. 1.0mol D. 1.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在严格无氧的条件下,碱与亚铁盐溶液反应生成白色胶状的 Fe(OH)2,在有氧气的情况下迅速 变为灰绿色,逐渐形成红褐色的氢氧化铁,故在制备过程中需严格无氧。现提供制备方法如下:
方法一:用 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)配制 FeSO4 溶液时需加入铁粉的原因是_____;除去蒸馏水中溶解的 O2常采用_____的方法。
(2)生成白色 Fe(OH)2 沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入 FeSO4 溶液液面下,再挤出 NaOH 溶液。这样操作的理由是_____。
方法二:
在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备。

(1)在试管Ⅰ里加入的试剂是_____;
(2)在试管Ⅱ里加入的试剂是_____;
(3)为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤 是_____。
(4)这样生成的 Fe(OH)2 沉淀能较长时间保持白色,其理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、在一定条件下的下列可逆反应达到平衡时,试填出:x A+y B![]() z C
z C
(1)若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z关系是________;
(2)若C是气体,并且x+y=z,在加压时化学平衡可发生移动,则平衡必定是向_____方向移动;
(3)已知B、C是气体,现增加A物质的量,平衡不移动,说明A是______(填状态);
(4)如加热后,C的百分含量减小,则正反应是________热反应。
II、如图所示向A中充入1 mol X 、1 mol Y,向B中充入2 mol X、2mol Y,起始时,V(A)=V(B)= a L。在相同温度和有催化剂存在下,两容器中各自发生下述反应:X(g)+Y(g)![]() 2Z(g)+W(g) ΔH<0。达到平衡时,V(A)= 1.2a L。
2Z(g)+W(g) ΔH<0。达到平衡时,V(A)= 1.2a L。
试回答:
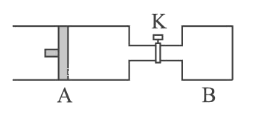
(1)A中X的转化率α(A)___________________________。
(2)A、B中X的转化率的关系:α(A) ___________α(B)。(填“<”“>”或“=”)
(3)打开K,一段时间又达到平衡,A的体积为___________L。(连通管中气体体积不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A.标准状况下,Cl2的摩尔质量为71g
B.Na2CO3属于钠盐、又属于碳酸盐,这是用交叉分类法分类的
C.摩尔是用来衡量微观粒子多少的一种物理量
D.氧化还原反应一定有氧元素参加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A. SO3+H2O=H2SO4 B. CaCO3![]() CaO+CO2↑
CaO+CO2↑
C. Zn+H2SO4=ZnSO4+H2↑ D. AgNO3+HCl=AgCl↓+HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com