
【题目】A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大。第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的最高价含氧酸根离子中其中心原子采取 杂化。
(3)与A、B形成的阴离子(AB-)互为等电子体的分子有 。
(4)基态D原子的核外电子排布式为 ,下图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比为 。

(5)向D的高价态硫酸盐溶液中逐滴滴加B的氢化物水溶液至过量,先出现沉淀,最后沉淀溶解形成溶液。写出此沉淀溶解的离子方程式:_ ___。
【答案】(8分)(1)C<O<N(2分) (2)sp2(1分) (3)N2或CO(1分,其它合理答案也给分)
(4)1s22s22p63s23p63d104s1(或[Ar] 3d104s1)(1分);1:5(1分)
(5)Cu(OH)2+4NH3H2O=[Cu(NH3)]2++2OH-+4H2O(2分)
【解析】
试题分析:A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大, B原子的最外层p轨道的电子为半充满结构,最外层电子排布为2s22p3,故B为氮元素。第二周期元素A原子的核外成对电子数是未成对电子数的2倍,故原子核外电子排布为1s22s1或1s22s22p2,结合(3)能与N元素形成阴离子(AN-),故A为碳元素;C是地壳中含量最高的元素,所以C是氧元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,故D元素原子各层电子数分别为2、8、18、1,是29号Cu元素。(1)C、N、O元素是同一周期元素,同一周期元素自左向右非金属性逐渐增强,第一电离能呈增大趋势。但由于氮元素原子2p能级是半充满稳定状态,能量较低,所以第一电离能高于同周期相邻元素,故第一电离能由小到大的顺序为C<O<N。
(2)A的最高价含氧酸根离子是CO32-,根据价层电子对互斥理论可知,其中碳原子含有的孤对电子对数=(4+2-3×2)÷2=0,这说明碳原子最外层电子数全部成键,没有孤电子对,杂化轨道数目为3,采取sp2杂化。
(3)原子数和价电子数分别都相等的是等电子体,因此将CN-中碳原子及1个负电荷换成1个氮原子,可得的等电子体N2,将N原子及1个负电荷换成1个O原子,可得的等电子体CO,即互为等电子体的是N2或CO。
(4)D的原子序数是29,为Cu元素,根据构造原理可知,其原子核外电子排布式为1s22s22p63s23p63d104s1。由晶胞结构可知,Ca原子处于顶点,所以根据均摊法可知晶胞中含有Ca原子数目为8×![]() =1个。Cu原子处于晶胞内部与面上、面心处,所以晶胞中Cu数目为1+4×
=1个。Cu原子处于晶胞内部与面上、面心处,所以晶胞中Cu数目为1+4×![]() +4×
+4×![]() =5个,故该合金中Ca和Cu的原子个数比为1:5。
=5个,故该合金中Ca和Cu的原子个数比为1:5。
(5)将氨水滴加到硫酸铜溶液中,首先反应生成氢氧化铜沉淀,继续滴加氨水,氢氧化铜与氨水反应生成四氨合铜络离子,反应的离子方程式为Cu(OH)2+4NH3H2O=[Cu(NH3)]2++2OH-+4H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为___________。已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() =________。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=________。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全_______________________。(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) ![]() FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如右图所示,则8分钟内CO的平均反应速率v(CO)=______。

(2)写出该反应平衡常表达式:K=__________;下列措施中能使该反应的平衡常数K增大的是____(填序号)。
A.升高温度 B.增大压强 C.充入CO D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入少量的CO2,则CO2的转化率将______ (填“增大”、“减小”、“不变”)。
(4)铁的重要化合物在生产生活中应用十分广泛。
①高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为____________。
②高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述错误的是____(填序号)。
A.放电时每转移6mol电子,负极有2mol K2FeO4被还原
B.充电时阴极反应为:Zn(OH)2 +2e-=Zn+ 2OH-
C.放电时正极反应为:FeO42-+ 3e-+ 4H2O= Fe(OH)3+ 5OH-
D.充电时阳极附近溶液的碱性减弱
(5)已知:2CO(g)+O2(g)= 2CO2(g) △H=-566 kJ/mol
2H2(g)+ O2(g)= 2H2O(g);△H=-483.6 kJ/mol
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】顺-1,2-二甲基环丙烷(g)和反-1,2-二甲基环丙烧(g) 可发生如下转化:
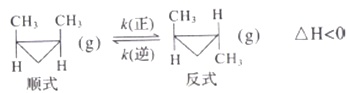
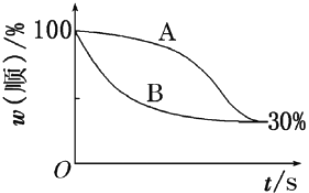
该反应的速率方程可表示为: v(正)=k(正)c(順)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。1温度下,k(正)=0.006s-1 ,k(逆)=0.002s-1。下列说法错误的是
A. t1温度下,反应的平衡常数值K1=3
B. 该反应的活化能Ea(正)小于Ea(逆)
C. t2温度下,上图中表示顺式异构体的质量分数随时间变化的曲线为B曲线
D. 由上图信息可以确定温度t2小于t1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年5月7日,天津某工程检测公司在进行探伤作业期间,一枚黄豆粒大小的放射源铱-192丢失,造成了严重的安全事故,图示是铱在元素周期表中的信息,下列说法正确的是( )
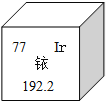
A. 铱的相对原子质量为192.2克
B. 铱原子核内的中子数为77
C. K2IrO3中Ir的化合价为+4
D. 生活中常用的铱金笔为纯净的铱单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式不正确的是( )
A.H2SO4═2H++SO42-B.NH4NO3=NH4++NO3-
C.NaHCO3═Na++H++CO32-D.Ba(OH)2═Ba2++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在溶液中大量共存的一组离子是( )
A.Cu2+、SO42-、OH—、K+B.Na+、CO32-、H+、Cl-
C.H+、Cl-、NO3-、Ba2+D.Ca2+、H+、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
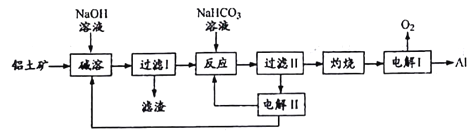
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为____________。
(2)向“过滤I”所得滤液中加入NaHCO3溶液,溶液的PH_____(填“增大”、“不变”或“减小”),NaHCO3中存在化学键有______
(3)“电解I”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是________。
(4)“电解II”是电解Na2CO3溶液,原理如图所示。

阳极的电极反应式为_______,阴极产生的物质A的化学式为_______。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为海水利用的部分过程。下列有关说法正确的是
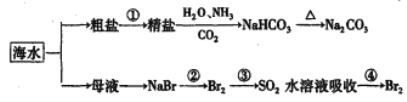
A. 粗盐提取精盐的过程只发生物理变化
B. 用澄清的石灰水可鉴别Na2CO3产品是否含有NaHCO3
C. 在第②、④步骤中,溴元素均被还原
D. 制取NaHCO3的反应是利用其溶解度小于NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com