
【题目】(1)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为___________。已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() =________。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=________。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全_______________________。(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
【答案】 Cu(OH)2 Cu2++2NH3·H2O===Cu(OH)2↓+2 NH4+ 2.7×10-3 c(Fe3+)=Ksp/c3(OH-)=1.1×10-3 mol·L-1>1×10-5 mol·L-1,故Fe3+没有沉淀完全
【解析】试题分析:本题考查与溶度积有关的计算。
(1)Mg(OH)2和Cu(OH)2的类型相同,Ksp[Mg(OH)2] ![]() Ksp[Cu(OH)2],开始溶液中Mg2+和Cu2+浓度相等,加入氨水先达到Cu(OH)2的溶度积,则加入氨水先生成Cu(OH)2沉淀,反应的离子方程式为Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+。
Ksp[Cu(OH)2],开始溶液中Mg2+和Cu2+浓度相等,加入氨水先达到Cu(OH)2的溶度积,则加入氨水先生成Cu(OH)2沉淀,反应的离子方程式为Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+。
(2)因为两种沉淀共存,则溶液中c(Ag+)·c(Br-)=Ksp(AgBr),c(Ag+)·c(Cl-)=Ksp(AgCl),![]() =2.7
=2.7![]() 10-3。
10-3。
(3)pH=3时溶液中c(OH-)=1![]() 10-14
10-14![]() (1
(1![]() 10-3)=1
10-3)=1![]() 10-11mol/L,c(Fe3+)=Ksp/c3(OH-)=1.1
10-11mol/L,c(Fe3+)=Ksp/c3(OH-)=1.1![]() 10-36
10-36![]() (1
(1![]() 10-11)3=1.1
10-11)3=1.1![]() 10-3mol/L
10-3mol/L![]() 1
1![]() 10-5mol/L,Fe3+没有沉淀完全。
10-5mol/L,Fe3+没有沉淀完全。


科目:高中化学 来源: 题型:
【题目】关于烷烃性质的叙述,错误的是
A. 烷烃不能使酸性高锰酸钾溶液褪色
B. 烷烃都能燃烧
C. 烷烃在水中的溶解度随着碳原子数的增加而增大
D. 烷烃都能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(ρ=1.84 g/cm3)配制1 mol/L稀硫酸100 mL。
(1)实验操作:
a.用100mL量筒量取98%的浓硫酸___________mL;
b.选取对应规格的容量瓶,洗涤,检查是否漏液,将稀释并冷却至室温的硫酸溶液沿玻璃棒转移到此容量瓶中;
c.用少量蒸馏水洗涤小烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中;
d.在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌;
e.向容量瓶中直接加蒸馏水至离刻度线1~2 cm处;
f.盖上容量瓶瓶塞,摇匀;
g.用胶头滴管小心加蒸馏水至刻度线;
h.将配制好的溶液转移入含少量蒸馏水的试剂瓶中贮存备用。
(2)实验
①正确的操作步骤是__________________________________________________(填序号)。
②此实验中玻璃棒的作用是__________________________________________________。
③实验操作中有两处错误,这两处错误是:________________________、_________________________。
(3)下列操作对所配溶液的浓度有何影响?(填“偏高”“偏低”或“无影响”)
①量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中______________。
②定容时俯视容量瓶刻度线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将224 L氯化氢气体溶于635 mL的水(密度为1.00 g/cm3)中,所得盐酸的密度为1.18 g/cm3。求:
(1)该盐酸的溶质质量分数是多少?______________
(2)取这种盐酸10.0 mL,稀释到1.00 L,所得的稀盐酸的物质的量浓度多少?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石(主要成分为 CuCO3·Cu(OH)2、CuSiO3·2H2O,含 SiO2、FeCO3、 Fe2O3等杂质)为原料制备CuCl2的工艺流程如下:
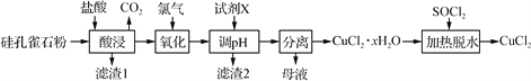
(1)为提高“酸浸”时铜元素的浸出率,可以采取的措施有:
①适当加快搅拌速率;②______________。(任答一点即可)
(2)“氧化”时发生反应的离子方程式为__________。
(3)“滤渣1”的主要成分为SiO2和H2SiO3等,“滤渣2”的主要成分为______(填化学式);试剂X可选择_____(填字母)。
a. Cu b. NaOH c. Cu(OH)2 d.氨水
(4)“调pH”时,pH不能过高,其原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒后驾车是马路上的第一大杀手。已知酒精(C2H5OH)能与K2Cr2O7和H2SO4的混合溶液在一定条件下发生如下反应:2K2Cr2O7+3C2H5OH+8H2SO4 2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O,且知Cr2O72-和Cr3+在溶液中分别显橙色和绿色,回答下列问题:
(1)该反应________(填“是”或“不是”)离子反应。
(2)写出Cr2(SO4)3的电离方程式:______________________________________。
(3)该反应________(填“是”或“不是”)氧化还原反应,判断的依据是_________________________________。
(4)你认为能否用这一反应来检测司机是否酒后驾车?________(填“能”或“不能” ),简述其原理________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列反应的化学方程式,用双线桥法标明电子转移的方向和数目,并注明“被氧化”、“被还原”。
①Fe2O3与CO在高温下的反应:___________________________________。
②KClO3与MnO2在共热条件下反应:________________________________。
③H2S气体和SO2气体反应生成S和水:______________________________。
(2)写出下列反应的离子方程式,并用单线桥法标明电子转移的方向和数目。
①Cu和AgNO3溶液反应:________________________________________。
②实验室制Cl2的反应为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O:___________________________。
MnCl2+Cl2↑+2H2O:___________________________。
③向FeCl2溶液中通入Cl2生成FeCl3:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,甲、乙两池中均为1 mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始时先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流表指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是( )

A. 闭合K1,断开K2后,A电极增重
B. 闭合K1,断开K2后,乙池溶液浓度上升
C. 断开K1,闭合K2后,A电极发生氧化反应
D. 断开K1,闭合K2后,NO![]() 向B电极移动
向B电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大。第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的最高价含氧酸根离子中其中心原子采取 杂化。
(3)与A、B形成的阴离子(AB-)互为等电子体的分子有 。
(4)基态D原子的核外电子排布式为 ,下图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比为 。

(5)向D的高价态硫酸盐溶液中逐滴滴加B的氢化物水溶液至过量,先出现沉淀,最后沉淀溶解形成溶液。写出此沉淀溶解的离子方程式:_ ___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com