
【题目】在标准状况下,将224 L氯化氢气体溶于635 mL的水(密度为1.00 g/cm3)中,所得盐酸的密度为1.18 g/cm3。求:
(1)该盐酸的溶质质量分数是多少?______________
(2)取这种盐酸10.0 mL,稀释到1.00 L,所得的稀盐酸的物质的量浓度多少?____________
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】已知X、Y为有刺激性气味的气体,有以下转化关系,部分产物未标出。

试回答:
(1)写出下列物质的化学式
X________、 Y________ 、A________ 、B______、 C________。
(2) 反应①的化学方程式为____________________________,
反应②的离子方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

溶质的物质的量 | 溶液的密度 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为_____(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为_____mol·L-1。
(3)物质的量浓度为c2mol·L-1的氨水与![]() c2mol·L-1的氨水等质量混合,所得溶液的密度_____ (填“大于”、“小于”或“等于”,下同)ρ2g·cm-3,所得溶液的物质的量浓度_____
c2mol·L-1的氨水等质量混合,所得溶液的密度_____ (填“大于”、“小于”或“等于”,下同)ρ2g·cm-3,所得溶液的物质的量浓度_____![]() c2mol·L-1(设混合后溶液的体积变化忽略不计)。
c2mol·L-1(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
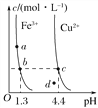
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理对生产有重大的指导意义。回答下列问题:
(1)有两个温度相同的密闭容器A和B,容器A保持容积不变,容器B保持压强不变,起始时向容积相等的A、B中分别充入等量的C(碳)和H2O(g),发生反应:C(s)+H2O(g)![]() CO(g)+ H2(g) (正反应为吸热反应),并分别达到平衡。
CO(g)+ H2(g) (正反应为吸热反应),并分别达到平衡。
①H2O的体积分数:V(A)%_____V(B)%。(填“>”、“<” “=”)
②达到平衡后,在两容器中分别通入等量的氦气,则A中H2O的转化率_______(填“增大” “减小”、“不变”);B中化学平衡_________移动(填“不”“向正反应方向”“向逆反应方向”)。
(2)某温度下,测得0.01mol·L-1 NaOH溶液的pH=10,则在该温度下Kw=______;在此温度下,将pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得溶液为中性,则a:b=_______(假设混合时体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为___________。已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() =________。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=________。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全_______________________。(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】顺-1,2-二甲基环丙烷(g)和反-1,2-二甲基环丙烧(g) 可发生如下转化:
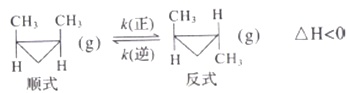
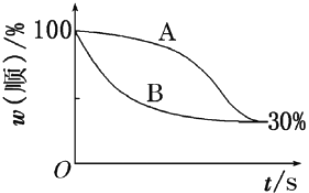
该反应的速率方程可表示为: v(正)=k(正)c(順)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。1温度下,k(正)=0.006s-1 ,k(逆)=0.002s-1。下列说法错误的是
A. t1温度下,反应的平衡常数值K1=3
B. 该反应的活化能Ea(正)小于Ea(逆)
C. t2温度下,上图中表示顺式异构体的质量分数随时间变化的曲线为B曲线
D. 由上图信息可以确定温度t2小于t1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com